Метилацетамид
Cтраница 1
Метилацетамид и N-метилпропионамид довольно легко ( при 70 - 80е) цианэтилируются в присутствии едкого натра. [1]
Метилацетамид CH3CONHCH3 интересен как простейший представитель группировки RCONHR, характерной для пептидов. Спектр ЯМР этого соединения при рН 5, кроме широкой линии NH и линии, обусловленной протонами С - СН3, содержит две линии, чувствительные к изменению рН: а) дублет, обусловленный протонами N - СН3, расщепленный в результате спин-спинового взаимодействия с протонами NH, и б) одиночную линию, обусловленную водой. По мере увеличения или уменьшения значения рН пики N - СН3 сливаются в синглет, что указывает на возрастание скорости обмена протонов NH; линия воды уширяется вследствие обмена протонов между водой и NH. Время жизни т для обмена было определено по линии N - СН3, как и в случае метиламина ( стр. [2]
Метилацетамид и N-метилпропионамид довольно легко ( при 70 - 80е) цианэтилируются в присутствии едкого натра. [3]
 |
Связь между константами. [4] |
Действительно, основность метилацетамида выше, чем у воды, поэтому энергия сольватации протона метилаце-тамидом должна быть выше, чем энергия сольватации водой. [5]
Другие органические амиды, такие, как формамид, N метил-фор мамид и М - метилацетамид, имеющие высокие диэлектрические постоянные, также исследовали в качестве растворителей для электрохимических процессов Однако ни один из них не обнаружил существенных преимуществ по сравнению с ДМФА или МП, а в некоторых отношениях эти растворители оказались менее удобны. [6]
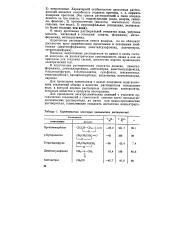 |
Характеристика некоторых органических растворителей. [7] |
К числу протонных растворителей относятся вода, уксусная кислота, метиловый и этиловый спирты, формамид, метил-формамид, метилацетамид. [8]
Из других растворителей были исследованы ацетон [43], ангидрид уксусной кислоты [44], анилин [45, 46], бензоилхлорид [47], бутанол [48], ди-метилформамид [34, 49, 50], диметилсульфоксид [90, 91], диоксан [51-53] ( его смеси с водой), формамид [54-56], моноэтиловый эфир гликоля ( цел-лозольв) [57], гидразин [58], метансульфоновая кислота [59], морфолин 160 ], пиридин [61], М - метилацетамид [108], причем продолжают публиковаться работы [62, 63], авторы которых стремятся найти новые растворители, применимые для целей полярографии. [9]
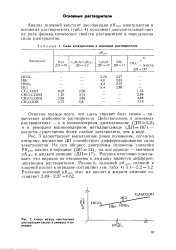 |
Сила электролитов в основных растворителях.| Связь между константами диссоциации кислот в аммиаке и пн-ридине. [10] |
Отметим прежде всего, что здесь правит бал химия - химические особенности растворителя. Действительно, в основных растворителях - и в низкополярном диэтеланилине ( ДП 5 2) и в рекордно высокополярном метилацетамиде ( ДП 187) - кислоты существенно более слабые электролиты, чем в воде. [11]
К существенному увеличению растворяющей способности, - а иногда и селективности приводит переход от соединений с сильными межмолекулярными водородными связями к сравнительно слабоассоциированным растворителям. Например, диметилацетамид, как следует из табл. 13, образует значительно менее неидеальную систему с бензолом и проявляет большую селективность по отношению к смеси гексан-бензол, чем сильноассоциировавный метилацетамид. [12]
Прежде всего, вода влияет на водородные связи в глобуле. Для стабилизации элементов вторичной структуры и пространственной структуры в целом необходимо, чтобы образование внутримолекулярных водородных связей давало бы больший выигрыш свободной энергии, чем образование водородных связей с молекулами воды. Эти эффекты, однако, не столь значительны. Клотц и Франклин [79, 80] установили, что образование водородносвязанных димеров метилацетамида Н3С - NH - СОСН3 энергетически выгодно в органических растворителях, но не в воде. Теплота образования димера в ССЦ равна 4 0 ккал / моль, в СНС13 она равна 1 6 ккал / моль, а в воде близка к пулю. [13]
Успех этой реакции зависит от обмена галоида между дихлоридом и йодистым натрием. Чтобы реакция проходила лишь с каталитическими количествами йодистого натрия, необходимо регенерировать ион иода из анионизированного йодистого цинка, образовавшегося при реакции циклизации. Эта задача выполняется аце-тамидом и карбонатом натрия, первоначально образующими комплекс ж затем вступающими в реакцию обмена. Смит, Поль и Никодемус [29] усовершенствовали метод Хасса-Мак - Би, изменив реакционную среду на формамид, метилацетамид, бутилбутират, пиридин и изогексановую кислоту: все испытанные вещества оказались пригодными. Чтобы предсказать исход синтеза данного циклопропана из определенного а у-дибромида, необходимо знать природу дибромида. [14]
Выполнение анализа в случае легко восстанавливаемых амидов и легко летучих с водяным паром аминов. С целью разрушения избытка реагента прибавляют по каплям воду, затем 10 мл бн. Индикатором служит раствор, содержащий метиловый красный и мети-леновый синий, конечная окраска - зеленая. Результаты вычисляют обычным образом. Целесообразно провести контрольный опыт. Этим способом могут быть определены, например, амиды муравьиной, уксусной, пропионовой, масляной, у-гилрокспмаслянок и ме-тилгликолевой кислот, Л - метилацетамид, А / У - диметилоксамид, диметилформамид, октиламид, бензамид, сукцинимид и N-метил-пирролидон. [15]
Страницы: 1