Мультиплетность - терм
Cтраница 3
Мультиплетность термов атомов при / S-связи определяется числом различных способов образования полного момента атома при данных значениях спина и орбитального момента атома. Мультиплетность линий излучения определяется мультиплетностью термов и правилами отбора для спина, орбитального и полного моментов при оптических переходах. [31]
Эта энергия не характеризует полностью квантовое состояние, так как могут существовать несколько состояний, обладающих одинаковыми или почти одинаковыми энергиями, которые вместе образуют вырожденное состояние. Число таких одинаковых состояний называется мультиплетностью терма или априорной вероятностью и находится из квантовой механики. Энергия каждого уровня молекулы по отношению к основному состоянию находится экспериментально из полосатых спектров. Последние представляют собой группы спектральных линий, испускаемых молекулами при прохождении электрического разряда через газ или поглощаемых молекулами из непрерывного спектра. Испускание света происходит при переходе с высшего на низший электронный уровень ( инфракрасное излучение полярных молекул происходит также и при переходах между различными колебательными и вращательными уровнями), в то время как поглощение света вызывает обратный процесс. [32]
Спектральные линии, наблюдаемые как результат перехода из одного состояния ( терма) в другое, расщеплены в результате мультиплетности термов. Изучение спектра позволяет таким образом определять мультиплетность термов. [33]
Таким образом, при L 5 квантовое число J принимает 2 / - f - l, а при L S-2 - S - f - l различных значений. Величина x2S - - l определяет степень мультиплетности термов. Эти правила позволяют определить для любой электронной конфигурации число возможных термов. [34]
Формула основного состояния отвечает действительному положению лишь в общих чертах, но не в деталях. Это не относится к бира-дикальным структурам, отличающимся по мультиплетности термов. [35]
Так же, как и в атоме, вторым квантовым числом в молекуле является результирующий электронный спин 5, который может быть целым или дробным числом в зависимости от того, является ли число электронов в молекуле четным или нечетным. Число спиновых состояний, соответствующих данному значению Л и равное 2S 1, называют мультиплетностью терма. [36]
Так же, как и в атоме, вторым квантовым числом в молекуле является результирующий электронный спин S, который может быть целым или дробным числом в зависимости - от того, является ли число электронов в молекуле четным или нечетным. Число спиновых состояний, соответствующих данному значению Л и равное 2S 1, называют мультиплетностью терма. Значения S 0 - 2 -, соответствуют синглетному, дублетному и три-плетному состояниям. [37]
Одновременное возбуждение двух Ss-электронов, а также других электронов атома Zr приводит к возникновению большого количества групп термов. В табл. 285 приведены группы термов, учитываемые в последующих расчетах, с указанием их сериальных границ и мультиплетности термов. Как видно из таблицы, эти группы возникают при возбуждении одного или двух Ss-электронов. Остальные группы термов не учитывались, поскольку их уровни имеют энергии возбуждения порядка 70 000 см 1 и выше. [38]
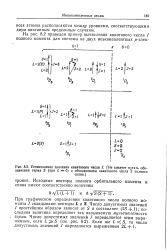 |
Установление значения квантового числа /. [ Не следует путать обозначения терма S ( при L 0 с обозначением квантового числа 5 полного. [39] |
При графическом определении квантового числа полного момента J складывают векторы L и S. Число допустимых значений / простейшим образом зависит от S и составляет ( 25 1); последняя величина определяет так называемую мультиплетность терма. [40]
Рассмотрим, например, разрыв связи N - О в молекуле NaO. В результате диссоциации происходит переход из - состояния линейной молекулы NaO в состояние XS и 3Р молекулы N2 и атома О, причем обычно считается, что изменение мультиплетности терма происходит вблизи точки пересечения термов устойчивого 1Е - состояния ( терм 1) и неустойчивого 3П - состояния ( терм 2) молекулы NaO. Этот процесс считается неадиабатическим, поскольку в результате реакции меняется мультиплетность, а следовательно, и электронные квантовые числа молекулы. [41]
С помощью спектроскопов большой разрешающей силы было обнаружено, что многие спектральные линии состоят из двух, трех или большего числа тонких линий. Например, в главной серии оптического спектра натрия наблюдаются двойные ( дублетные) линии с длинами волн 5890 и 5896 А. Мультиплетность терма обозначается числовым индексом при буквенном обозначении терма. Например, 2S означает дублетный терм S. [42]
Аналогия продолжается и далее. Так же, как и в многоэлектронных атомах, спины отдельных электронов в молекуле образуют результирующий спин S. Величина g2S l характеризует мультиплетность терма и записывается в виде верхнего левого индекса у символа терма. [43]
При векторном суммировании L и S могут быть параллельны или антипараллельны. Следовательно, для J оказываются возможными 2S 1 значений. Величину 2S 1 называют мультиплетностью терма. [44]
При векторном суммировании L и 5 могут быть параллельны или антипараллельны. Следовательно, для J оказываются возможными 2S 1 значений. Величину 25 1 называют мультиплетностью терма. [45]
Страницы: 1 2 3 4