Неделимость - атом
Cтраница 1
Неделимость атомов Дальтон связывает непосредственно с законом сохранения материи. Химический анализ и синтез, - пишет он, - идут не далее, чем до отделения частиц друг от друга и их воссоединения. Дальтон сравнивает попытку разрушить или создать атом водорода с попыткой разрушить одну из планет солнечной системы или создать новую планету. Но если в силу своей недробимости атомы вступают в соединение только целыми единицами, то тем самым строение сложных атомов, образованных из целого числа атомов различных элементов, объясняет простоту и кратность отношений в составе химических соединений. [1]
Такая неделимость демокритовского атома не исключала мысленного различения в нем еще более мелких частей. Какие это семь частей, явствует из параллельного текста Августина: Сколь бы мало и было такое тельце ( corpusculum), конечно, оно имеет правую и левую часть, верхнюю и нижнюю, заднюю и переднюю, или, иначе говоря, наружные части и среднюю. [2]
Хотя спор о неделимости атомов продолжался до начала XX в. В 1907 г. Кельвин заявил, что атом неразрушим. Однако некоторые замечательные открытия ниспровергли утвердившееся было мнение о неделимости атома. [3]
Именно в таком смысле толковал неделимость атома у древних атомистов Аристотель: наделяя физические атомы неизменной геометрической формой, уже тем самым приходится утверждать их неделимость. Это в одинаковой мере относится и к платоникам, которые приписывали огню пирамидальную форму, и к Демокриту, считавшему, что атомы огня - сферические. [4]
В то время почти что неделимость атома является основ-этой теории. [5]
Такое представление, не требуя абсолютной неделимости атомов, выражает все то, что может требовать наука от гипотетического представления о строении вещества. Еще ближе к чисто динамическому представлению подходит многократно возрождавшаяся вихревая гипотеза строения тел. Декарт первый старался развить ее, Гельмгольц и Томсон ( лорд Кельвин) дали ей более полную и современную форму. [6]
Открытие явления радиоактивности развеяло миф о неделимости атома и неопровержимо показало возможность превращения одного элемента в другой. [7]
Однако дальнейшее развитие науки показало, что неделимость атомов имеет относительный характер и что в действительности атом представляет сложную систему, способную разрушаться на другие, еще более мелкие ( элементарные) частицы. Перед физикой встал вопрос: как устроен атом. [8]
Указанные явления позволили установить, что представление о неделимости атома является ошибочным, ибо в результате радиоактивного распада возникают новые элементы, обладающие определенными свойствами и занимающие свои места в таблице элементов Менделеева. Распад атомов радиоактивных веществ сопровождается выделением энергии. [9]
Кризис классического естествознания связан с преодолением представления о неделимости атомов, как элементарных составляющих Вселенной. [10]
В этом контексте опять проступает вся разница между неделимостью физического атома ( или математического неделимого) и неделимостью индивидуума. [11]
Любопытно, что некоторые попытки гассендистов ближе определить природу неделимости атома напоминали средневековые понятия о differentiae respectivae loci. Так, по Бернье, трудности построения континуума из неделимых существуют лишь в том случае, если мыслить эти неделимые как математические точки, которые, не имея частей, не могут соприкасаться частично, а должны сливаться друг с другом. Этих труд-костей, по Бернье, нет для тех, кто признает лишь физические точки и мгновения. [12]
В то время аочти общим было также мнение, что неделимость атома является основным и неотъемлемым положением этой теории. [13]
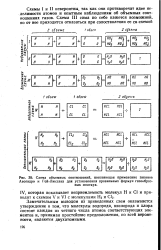 |
Схема объемных соотношений, поясняющая применение законов Авогадро н Гей-Люссака для установления правильных формул газообразных молекул. [14] |
Схемы I и II невероятны, так как они противоречат идее неделимости атомов и опытным наблюдениям об объемных соотношениях газов. [15]
Страницы: 1 2 3