Окисление - окись
Cтраница 1
Окисление окиси диметиламинофениларсина в соответствующую арсоновую кислоту можно производить обработкой окисью ртути 1539; диметиламинофениларсоновая кислота ( диметилатоксил) ( СН3) 2 N QH4 AsO ( OH) 2 значительно легче получается при действии на окись диметиламинофениларсина 30 % перекиси водорода в растворе едкого натра. [1]
 |
Зависимость выхода окиси. [2] |
Окисление окиси - и абсорбция двуокиси азота водой осуществляются практически одновременно в одной и той же аппаратуре. Однако закономерность этих inn процессов целесообразно рассмотреть раздельно. [3]
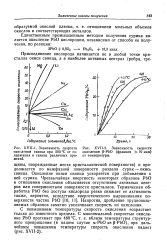 |
Зависимость скорости [ IMAGE ] XVII-2. Зависимость скорости. [4] |
Окисление окиси свинца ускоряется при добавлении к ней сурика. Чрезвычайная инертность некоторых образцов РЬО в отношении окисления объясняется отсутствием активных центров или совершенством поверхности кристаллов. Напротив, дробление трудноокисляемых образцов заметно увеличивает скорость их окисления. [5]
Окисление окиси тритолилфосфина [ С6Н4 ( СН3) ] 3РО в окись три-карбокситрифенилфосфина РО ( С6Н4 СООН) 3 производится хромовой кислотой в растворе ледяной уксусной кислоты. [6]
 |
Окисление окиси этилена на магний-хромовом катализаторе при разных температурах. [7] |
Окисление окиси этилена воздухом на окисных катализаторах ( магний-хромовый и медно-хромозый, нанесенные на асбест) и на серебре проводили69 70 в проточной установке при атмосферном давлении. Как видно из рис. 24, с повышением температуры увеличивается глубина окисления окиси этилена. Установлено, что на указанных катализаторах окись этилена превращается в двуокись углерода и воду. [8]
Окислением окиси мышьяка ( З) азотной кислотой до мышьяковой кислоты и добавлением окисн свинца ( глета) с уксусной кислотой или без нее. [9]
Изучение окисления окиси этилена на серебре показало, что она превращается в углекислый газ и воду, но количества их не эквивалентны израсходованному С2Н40; это заставило автора предположить образование на поверхности контакта адсорбированного органического остатка. [10]
Изучение окисления окиси этилена на серебре показало, что она превращается в двуокись углерода и воду, но количества СО2 и Н2О не эквивалентны израсходованной окиси этилена, и это заставило предположить образование органического остатка X на поверхности серебра. Кроме того, при пропускании окиси этилена над серебром в продуктах реакции был обнаружен этилен, который мог образоваться при разложении окиси этилена. Этилен может превратиться в продукты глубокого окисления, минуя стадию окиси этилена - путем образования ( 2) и разложения ( 5) формальдегида. [11]
Метод окисления окиси этилена ( МАК50 млн 1 90 мг / м3) йодной кислотой и определения в виде формальдегида впервые описан Гейджем [ 173а ], фирмой ICI разработана упрощенная методика. В то время как методика фирмы ICI предусматривает простую абсорбцию этиленоксида водой, Гейдж избегает возможных при этом потерь, проводя абсорбцию на силикагель. Поглощенную окись этилена по обеим методикам окисляют до формальдегида нагреванием с йодной кислотой. Избыток йодной кислоты связывают арсенитом натрия и образовавшийся формальдегид определяют по реакции с ацетилацетоном, фотометрируя появляющуюся при рН 6 желтую окраску. [12]
При окислении окиси этилена в зависимости от условий реакции и природы окислителя получаются либо гликолевая кислота, либо ( при глубоком окислении) двуокись углерода и вода. [13]
Скорость реакции окисления окиси хрома Сг2О3 ( трехвалентный хром) в хромовый ангидрид СгОз ( шестивалентный хром) возрастает с повышением температуры. При 1000 реакция протекает еще медленно. Более высокая температура способствует сплавлению шихты, что затрудняет протекание реакции окисления. Чтобы предотвратить сплавление прокаливаемой смеси в шихту вводят наполнители-доломит или известняк. [14]
Написать уравнение реакции окисления окиси хрома, учитывая, что в результате реакции получаются хромат калия, хромат натрия, нитрит калия и двуокись углерода. [15]
Страницы: 1 2 3 4