Понижение - давление - насыщенный пар - растворитель
Cтраница 1
 |
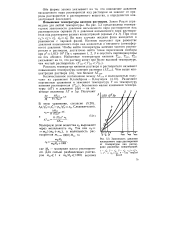
Зависимость давления насыщенного пара чистого растворителя ( I и над раствором ( 2, 3 от температуры. [1] |
Понижение давления насыщенного пара растворителя над раствором приводит к повышению-температуры кипения раствора по сравнению с температурой кипения чистого растворителя. [2]
Разность р - pi называется понижением давления насыщенного пара растворителя; ( pi - pi) jp - относительное понижение давления насыщенного пара растворителя; NZ - мольная доля растворенного вещества. [3]
Из этого уравнения следует, что понижение давления насыщенного пара растворителя над раствором неэлектролита прямо пропорционально молярной доле растворенного вещества. [4]
 |
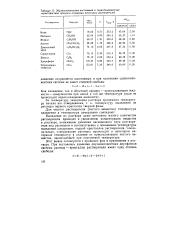
Зависимость давления насыщенного пара растворителя от температуры над растворами различных концентраций. [5] |
Обе формы закона указывают на то, что понижение давления насыщенного пара растворителя над раствором не зависит от природы растворителя и растворенного вещества, а определяется концентрацией последнего. [6]
 |
Определение относительной молекулярной массы полимера. [7] |
Растворы ВМС, как истинные растворы, подчиняющиеся правилу фаз, обнаруживают понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем, для них характерны отрицательные отклонения от закона Рауля. [8]
Раствор замерзает при более низкой температуре, чем чистый растворитель, что объясняется понижением давления насыщенного пара растворителя над раствором нелетучего вещества. [9]
 |
Эбулиоскопическая постоянная и термодинамические характеристики процесса испарения некоторых растворителей. [10] |
Выпадение из раствора даже ничтожно малого количества растворителя приводит к увеличению концентрации вещества в растворе, понижению давления насыщенного пара растворителя над раствором и соответственно к понижению температуры появления следующих порций кристаллов растворителя. Следовательно, отвердевание раствора происходит в некотором интервале температур в отличие от кристаллизации чистого вещества, происходящей при постоянной температуре. [11]
К практически важным свойствам растворов, изучение которых позволяет получить информацию о некоторых физико-химических параметрах веществ, относятся осмотическое давление, понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания и повышение температуры кипения раствора по сравнению с этими параметрами для чистого растворителя. [12]
При рассмотрении явления осмоса и равновесий в системе жидкость - пар ( см. § 5.6) было отмечено, что осмотическое давление и понижение давления насыщенного пара растворителя над раствором не зависят от природы растворителя и растворенного вещества, а определяются только концентрацией. [13]
Коэффициенты активности определяют также по ионной силе раствора ( см. § 8.6) и экспериментально эбулиоскопическим, крио-скопическим или осмотическим методом, методом ЭДС или по понижению давления насыщенного пара растворителя над раствором. [14]
В соответствии с последней, ионы в р-рах, как и молекулы растворенного в-ва, вызывают: понижение давления насыщенного пара растворителя над р-ром, ДР; повышение темп-ры кипения р-ра, ДТк; понижение темн-ры замерзания р-ра, ДТ3; повышение осмотич. S - 1), в к-ром а - степень электролитич. S - число ионов, на к-рые диссоциирует одна молекула электролита. [15]
Страницы: 1 2