Более сложные ассоциат
Cтраница 3
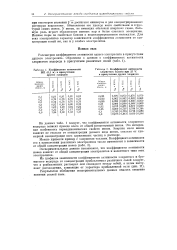 |
Коэффициент активности.| Коэффициент активности. [31] |
Объясняется это прежде всего свойствами и структурой самих ионов. У ионов, не имеющих оболочки инертных газов, большую роль играет образование ионных пар и более сложных ассоциатов. Ионные пары по свойствам близки к недиссоциированным молекулам. [32]
Объясняется это прежде всего свойствами и структурой самих ионов. У ионов, не имеющих оболочки инертных газов, большую роль играет образование ионных пар и более сложных ассоциатов. Ионные пары по свойствам близки к недиссоциированным молекулам. Для этих электролитов характер зависимости коэффициентов активности от концентрации такой же, как и у слабых электролитов, например, как у лгонохло руксусной кислоты. [33]
Объясняется это прежде всего свойствами и структурой самих ионов. У ионов, не имеющих оболочки инертных газов, большую роль играет образование ионных пар и более сложных ассоциатов. Ионные пары по свойствам близки к недиссоциированным молекулам. [34]
 |
Кинетические параметры процесса окисления метилэтилкетона в смесях его с водой при 60 С. [35] |
В настоящее время нет данных для того, чтобы связать кинетические эффекты, обусловленные образованием водородной связи, со строением радикалов, связанных в комплексы, или природой растворителя, являющегося донором водородной связи. В большинстве случаев, вероятно, следует считать доказанным, что комплекс радикал - растворитель имеет состав 1: 1, хотя в принципе возможны и более сложные ассоциаты. [36]
С повышением температуры от 30 до 60 С релаксационная сила уменьшается от 4 7 10 а до 3 7 - 10 - 2 ( см. табл. 1 1) Концентрация димеров растет от 0 9 моль до - 1 6 моль. Концентрация тримеров и более сложных ассоциатов, взятых вместе ( с - сх - с2), падает от - 1 6 моль до - 0 8 моль. Поэтому можно полагать, что акустическая релаксация в mpem - бутаноле, наблюдаемая в области частот от 10 МГц до 3 35 ГГц, обусловлена реакциями разрыва Н - связи в тримерах и более сложных ассоциатах. [37]
Пары щелочных металлов частично ассоциированы. Ассоциация растет с увеличением молярной массы элемента. В парах присутствуют димеры и более сложные ассоциаты. [38]
Таким же образом, как это было сделано выше, можно рассмотреть ассоциацию дефектов, имеющих заряды zq с г больше единицы. Энергия связи в этом случае увеличивается в ZiZ2 раз. Кроме того, возможно образование более сложных ассоциатов. При наличии одного типа дефектов с двойным отрицательным зарядом и дефектов другого типа с одинарным положительным зарядом могут возникать как однократно заряженные пары, так и нейтральные триплеты. [39]
Водородная связь влияет и на химическое поведение веществ. Так, фтористоводородная кислота - слабая кислота, тогда как соляная кислота представляет собой сильную кислоту. Причина заключается в способности HF образовывать при помощи водородных связей дифторид-ионы и другие более сложные ассоциаты. [40]
Следовательно, образование ионных тройников из ионных двойников - 3 ( К А -) - - [ К А-К ] [ А-К А - ] - приводит к увеличению электропроводности. Почему же при дальнейшем возрастании концентрации, как следует из данных Саханова, электропроводность вновь падает. Объясняется это тем, что ионные тройники так же, как и двойники, образуют еще более сложные ассоциаты. Два ионных тройника образуют агрегат из трех молекул, не несущих на себе электрического заряда. Естественно, что при этом электропроводность вновь падает. [41]
Следовательно, образование ионных тройников из ионных двойников-3 ( К А -) - IK А - К) [ А - К А - ] - приводит к увеличению электропроводности. Почему же при дальнейшем возрастании концентрации, как следует из данных Саханова, электропроводность вновь падает. Объясняется это тем, что ионные тройники так же, как и двойники, образуют еще более сложные ассоциаты. Два ионных тройника образуют агрегат из трех молекул, не несущих на себе электрического заряда. Естественно, что при этом электропроводность вновь падает. [42]
Следовательно, образование ионных тройников из ионных двойников - 3 ( К А -) - - 1К А - КЧ 1А - К А - ] - приводит к увеличению электропроводности. Почему же при дальнейшем возрастании концентрации, как следует из данных Саханова, электропроводность вновь падает. Объясняется это тем, что ионные тройники так же, как и двойники, образуют еще более сложные ассоциаты. Два ионных тройника образуют агрегат из трех молекул, не несущих на себе электрического заряда. Естественно, что при этом электропроводность вновь падает. [43]
Подвижность ионов в расплаве приводит к биполярному типу проводимости, причем характерно, что тот сорт ионов, который переносил ток в твердых ионных кристаллах униполярно, после расплавления переносит большую долю тока. Так, если t в твердом cc - Agl равно единице, то в расплавленном составляет 0 7 - 0 9 в зависимости от температуры. С другой стороны, подвижность ионов может вызвать развитие процессов ассоциации ( образование ионных пар, ионных тройников и более сложных ассоциатов) н комплексообразования, которые приводят к уменьшению структурных единиц, участвующих в переносе электричества н снижающих электрическую проводимость. [44]
Согласно ПЭГ реакции между кислотой и основаниями не всегда сопровождаются образованием новой кислоты и нового основания ( вопреки точке. Среда определяет кис-лотно-основ-ное поведение вещества. Во многих случаях кислотно-основного взаимодействия наблюдается образование газов, малорастворимых осадков, очень слабых электродов ( в том числе и молекул такого рода растворителей), устойчивых сложных или комплексных ионов, ионных пар или ионных тройников и более сложных ассоциатов. [45]
Страницы: 1 2 3 4