Коррозия - ряд - металл
Cтраница 1
Коррозия ряда металлов замедляется при добавлении к некоторым солевым растворам хроматов или бихроматов, а также при повышении содержания кислорода в растворе выше определенного предела. [1]
Коррозия ряда металлов и растрескивание углеродистых и низколегированных сталей исследовались применительно к условиям эксплуатации оборудования первичной и низкотемпературной сепарации агрессивного природного газа. [2]
Опытные данные о коррозии ряда металлов и сплавов, в том числе и на железной основе, указывают на то, что величина зерна мало влияет на скорость коррозии. Исключение составляют случаи, когда на границе зерен металла условия таковы, что коррозия может приобрести межкристаллитный характер. Увеличение размеров зерна в этих случаях приводит к увеличению скорости межкристаллитной коррозии: общая протяженность границ у крупнозернистого металла меньше, чем у мелкозернистого, и, следовательно, интенсивность коррозии на единицу длины границы зерна будет больше. [3]
Присутствие легкоокисляемых серу-содержащих веществ ускоряет коррозию ряда металлов в щелочах. [4]
Определены [80 ] количественные данные о скорости коррозии ряда металлов и сплавов в атмосфере фтора. По этим данным, магниевые сплавы устойчивее железа, но менее устойчивы, чем медь и ее сплавы. Еще устойчивее алюминий, глубина коррозии которого даже при 635 не превышает 1 5 мм в месяц. [5]
Опыты показывают, что омагничнвание водных систем позволяет уменьшить коррозию ряда металлов. [6]
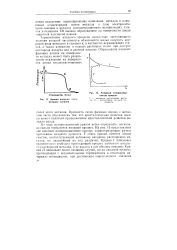 |
Анодные поляризационные кривые. [7] |
Торможением анодного процесса вследствие наступающего явления анодной пассивности объясняется малая скорость коррозии ряда металлов и сплавов и, в частности, нержавеющих сталей, а также алюминия в водных растворах солей при доступе кислорода воздуха или в азотной кислоте. [8]
При 200 - 550 С присутствие влаги и кислорода способствует заметному торможению коррозии ряда металлов и сплавов, так как на поверхности их образуются окисные пленки, препятствующие доступу хлора к поверхности металла. [9]
Хорошо известно, что некоторые кислородсодержащие анионы, например хроматы, в весьма малых концентрациях являются эффективными ингибиторами коррозии ряда металлов под действием воды. Эти результаты объясняли избирательной адсорбцией ингибитора на анодных центрах металлической поверхности; согласно другой точке зрения, при этом происходит непрерывное возобновление защитной пленки. [10]
В кислотах, обладающих окислительными свойствами ( азотная, серная и др.), при высоких концентрациях скорость коррозии ряда металлов уменьшается вследствие пассивации их поверхности. Так, например, скорость коррозии почти прекращается при воздействии на железо концентрированной ( выше 80 %) серной кислоты в связи с образованием на поверхности металла сульфата железа, нерастворимого в серной кислоте. [11]
Как ингибитор коррозии применяется сравнительно давно NaNOjj, в ряде случаев он является очень эффективным замедлителем. Известно, что при добавлении нитрита натрия значительно уменьшается коррозия ряда металлов не только в пресной воде, практически не содержащей солей, но и в растворах хлористого натрия и в морской воде. [12]
Как ингибитор коррозии применяется сравнительно давно NaNO2, в ряде случаев он является очень эффективным замедлителем. Известно, что при добавлении нитрита натрия значительно уменьшается коррозия ряда металлов не только в пресной воде, практически не содержащей солей, но и в растворах хлористого натрия и в морской воде. [13]
Среда внутри помещений химических производств зависит от физико-химических свойств обрабатываемых и получаемых про -; дуктов. Значительная часть химических веществ имеет токсичные свойства, а также вызывает коррозию ряда металлов, из которых выполнено электрооборудование. [14]
Для физической адсорбции характерна зависимость ее от заряда поверхно сти металла. Для специфической адсорбции такая зависимость менее выражена а химическая - практически не зависит от заряда поверхности металла. Многш ингибиторы адсорбируются на большинстве металлов физически, поэтому зна ние величины заряда поверхности имеет большое значение для предсказани. Для оценки возможности адсорбции органических ингИ биторов в условиях коррозии ряда металлов особое значение имеет потенциал нулевого заряда. [15]
Страницы: 1