Угловой коэфициент
Cтраница 1
Угловой коэфициент в декартовой прямоугольной системе координат представляет собой тангенс угла, который прямая образует с осью абсцисс. [1]
Угловые коэфициенты луча или прямой. Косинусы углов направления луча / с положительными направлениями осей координат cos ( /, х), cos ( /, у), cos ( /, г) называются направляющими косинусами луча. [2]
Получение углового коэфициента, близкою к нулю, еще не означает отсутствия смещения центра группирования. [3]
Здесь m означает угловой коэфициент ( tg о; см. 1) и 6 ординату точки пересечения прямой с осью у-ов. [4]
Ввиду того, что, как правило, / j больше, чем ГА, угловой коэфициент будет положителен, и поэтому скорость реакции между ионом и нейтральной молекулой должна уменьшаться с увеличением диэлектрической постоянной среды. [5]
Следовательно, связь между lg А и у т также должна быть линейной с тем же угловым коэфициентом. [6]
Из уравнения ( 68) сразу видно, что, если ионы А и В имеют противоположные знаки, то угловой коэфициент будет положительным, и, наоборот, он будет отрицательным при одинаковых зарядах. Экспериментальные результаты находятся в согласии с теоретическими выводами. Если сделать правдоподобные предположения о значениях ионных радиусов, то по уравнениям ( 68) и ( 69) можно вычислить угловые коэфициенты линейной зависимости In А, от 1 / D, которые находятся в превосходном согласии с опытом. [7]
Здесь Мй ( х0, уо, ZQ) - какая-либо точка на прямой и / j, / 2, / з - направляющие косинусы или угловые коэфициенты прямой. [8]
Если бы мы построили модель газовой залежи и провели экспериментальные определения зависимости между суммарным расходом Q газа и средним давлением р в пласте при различных начальных давлениях рн, то, как видно из уравнения ( 17, III), мы должны были бы получить семейство прямых, идущих параллельно, поскольку угловой коэфициент их Q остается неизменным. [9]
Если полученный таким образом электростатический потенциал нанести на график как функцию от энергии активации для реакций щелочного гидролиза замещенных бензойных эфиров, бензоилирования замещенных аминов и образования солей четырехзамещенного аммония, то получается почти прямая линия. Угловой коэфициент этой прямой для первой реакции почти точно равен величине заряда одного моля ионов гидроксила, откуда можно заключить, что изменение энергии активации почти целиком объясняется работой, необходимой для переноса иона гидроксила в ту точку поля диполя заместителя, в которой происходит реакция. Во многих случаях подобное соотношение существует также между потенциалом и логарифмом удельной скорости реакции. Это наблюдается, например, при этерификации замещенных бензойных кислот, катализируемой ионом водорода, при гидролизе замещенных галоидных бензилов и при реакции последних с йодистым калием. [10]
У т должна сохраняться, но угловой коэфициент должен зависеть от природы растворителя. Теоретические выводы и в этом случае подтверждаются экспериментально. [11]
Причина этого явления пока неясна. Однако зависимость рН раствора от концентрации добавляемой кислоты носит прямолинейный характер, причем угловой коэфициент прямой имеет теоретическое зяачснис. [12]
Из уравнения ( 68) сразу видно, что, если ионы А и В имеют противоположные знаки, то угловой коэфициент будет положительным, и, наоборот, он будет отрицательным при одинаковых зарядах. Экспериментальные результаты находятся в согласии с теоретическими выводами. Если сделать правдоподобные предположения о значениях ионных радиусов, то по уравнениям ( 68) и ( 69) можно вычислить угловые коэфициенты линейной зависимости In А, от 1 / D, которые находятся в превосходном согласии с опытом. [13]
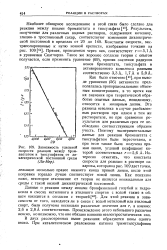 |
Зависимость удельной скорости реакции между бром-ацетатом и тиосульфатом от диэлектрической постоянной среды ( Ла-Мер. [14] |
Как было отмечено [45], при выводе уравнения ( 56) активности предполагались пропорциональными объемным концентрациям, в то время как их значения при теоретической обработке опытных данных, повидимому, относятся к молярным долям. Эта разница невелика в случае разбавленных растворов при одном и том же растворителе, но при сравнении результатов для различных сред ее необходимо соответствующим образом учесть. Поэтому экспериментальные данные для реакции бромацетата с тиосульфатом были пересчитаны, и при этом также была получена прямая линия, угловой коэфициент которой соответствовал г 5 6 А. Интересно отметить, что константа скорости для реакции в растворе сахарозы, которая на рис. 109 дает точки, лежащие несколько правее нижнего конца прямой линии, после этой поправки гораздо лучше соответствует новой линии. Как показано ниже, некоторое отклонение от теории не является неожиданным для среды с такой низкой диэлектрической постоянной. [15]
Страницы: 1