Атом - вольфрам
Cтраница 2
Семьдесят четыре электрона атома вольфрама расположены вокруг ядра таким образом, что шесть из них находятся на внешних орбитах и могут быть отделены сравнительно легко. Поэтому максимальная валентность вольфрама равна шести. Однако строение этих внешних орбит особое - они состоят как бы из двух ярусов: четыре электрона принадлежат предпоследнему уровню - d, который оказывается, таким образом, заполненным меньше чем наполовину. Известно, что число электронов в заполненном уровне d равно десяти. Эти четыре электрона ( очевидно, неспаренные) способны легко образовывать химическую связь. Что же касается двух самых наружных электронов, то их оторвать совсем легко. [16]
При работе йодно-кварцевой лампы атомы вольфрама нити испаряются и, соединяясь с атомами йода, образуют неустойчивые молекулы йодистого вольфрама. В зоне высокой температуры около нити происходит распад молекул йодистого вольфрама на атомы вольфрама и йода. [17]
Потенциал взаимодействия атом железа - атомы вольфрама вычисляется по аналогии с [21], как среднее между взаимодействиями типа атом железа - атом железа и атом вольфрама - атом вольфрама. [18]
Таким образом, иод возвращает атомы вольфрама в зону, окружающую нить и, следовательно, препятствует ее испарению. В йодных лампах на стенках стеклянного баллона не бывает и следов темного налета металлического вольфрама. По этой причине светоотдача таких ламп со временем не снижается, а срок службы увеличивается. [19]
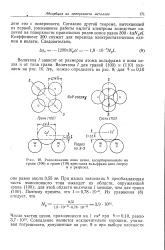 |
Расположение иона цезия, адсорбированного на. [20] |
Величина / зависит от размеров атома вольфрама и иона цезия и от типа грани. [21]
Изменение энергии х ПРИ перемещении атома вольфрама из плоскости ( 110) на центры, с которых происходит испарение, рассчитанное при допущении, что энергии связи в решетке между парами атомов аддитивны, составляет 5 5 эв. Для атома вольфрама, извлеченного из плоскости ( 211), эта величина равна 3 16 эв. [22]
Эти данные позволяют оценить ковалентный радиус атома вольфрама. А [10], находим для радиуса атома вольфрама 1 58 А. [23]
Атомы тория, отдав свои валентные электроны атомам вольфрама, имеюще го большую работу выхода, чем торий, располагаются на поверхности катода в виде положительных ионов. Между слоем ионов и поверхностью катода создается ускоряющее электрическое поле. Поэтому работа выхода электронов у такого катода меньше, чем у чистого тория, а эффективность значительно выше, чем у вольфрамового катода. [24]
Сколько главных энергетических уровней занимают электроны в атоме вольфрама. [25]
Сколько электронов находится на 4 / - подуровне атома вольфрама. [26]
Ясно также, что центры эмиссии не являются атомами вольфрама, частично вытянутыми из решетки. Даже если смещенные атомы и были бы способны мигрировать при низких температурах, то они либо перемещались бы, оставляя за собой дырки в поверхности, либо возвращались бы обратно в решетку и исчезали. [27]
Сколько подуровней включает уровень с я 4 в атоме вольфрама. [28]
Форма вольфрама, получаемая электролизом расплавленной соли, содержит атомы вольфрама двух видов. [29]
Во всех кристаллических соединениях, изученных рентгеноструктурным методом, атомы вольфрама и молибдена находятся в центре октаэдров, образованных атомами кислорода; все октаэдры соединены между собой либо общей вершиной, либо общим ребром, но никогда не соединяются общей гранью. [30]
Страницы: 1 2 3 4