Атом - благородный газ
Cтраница 4
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - например, гидраты Аг - бЬЬО, Кг - бРЬО, Хе - 6Н20, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратоз ( см. § 72); валентные связи при образовании подобных соединений не возникают. [46]
Можно даже предположить, что атомы благородных газов вообще очень антагонистически настроены друг к другу из-за отталкивания заполненных оболочек согласно принципу Паули. [47]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. [48]
Долгое время считалось, что атомы благородных газов не способны к образованию химических связей с другими элементами. [49]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - - например, гидраты Аг - 6Н2О, Кг - 6Н2О, Хе - 6Н2О, образующееся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов ( см. § 72); валентные связи при образовании подобных соединений не возникают. [50]
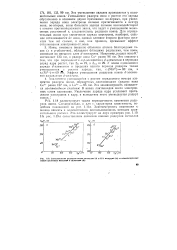 |
Сопоставление радиусов ионов металлов IA и ПА подгрупп ( а и изоэлектронных ионов щелочных металлов и галогенов ( б. [51] |
Ионы, имеющие внешние оболочки атомов благородных газов ( s и р-оболочки), обладают большими радиусами, чем ионы, имеющие во внешнем слое d - электроны. Например, радиус иона К составляет 133 пм, а радиус иона CLI равен 96 пм. Эффект уменьшения радиусов ионов d - элемен-тов называется d - сжатием. [52]
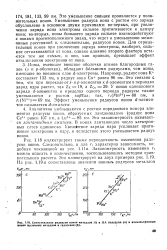 |
Сопоставление радиусов ионов металлов IA и ПА подгрупп ( а и изоэлектронны ионов щелочных металлов в галогенов ( б. [53] |
Ионы, имеющие внешние оболочки атомов благородных газов ( s и р-оболочки), обладают большими радиусами, чем ионы, имеющие во внешнем слое d - электроны. Например, радиус иона К составляет 133 пм, а радиус иона Си равен 96 пм. У ионов одинакового заряда d - элементов в пределах одного периода радиусы также уменьшаются с ростом заряда; так, г ( Мп2) 80 пм, а r - ( Ni2) 69 пм. Эффект уменьшения радиусов ионов d - элемен-тов называется d - сжатием. [54]
Кривая потенциальной энергии взаимодействия двух атомов благородных газов имеет минимум на расстояниях, где дисперсионная сила притяжения точно уравновешивается силой отталкивания, обусловленной перекрыванием замкнутых электронных оболочек. Эту силу обычно называют обменным отталкиванием, она становится значительной тогда, когда имеется достаточное перекрывание двух наборов атомных орбиталей, так что существует большая вероятность обмена между двумя атомами. [55]
 |
Схема электростатического взаимодействия центрального иона и лигандов в комплексе [ AgI2 ]. [56] |
Для переходных металлов электронная структура атомов благородных газов соблюдается далеко не всегда и поэтому в электростатических представлениях о химической связи в соединениях пере ходных металлов большую роль отводили зарядам и радиусам ионов. Потенциальная энергия [ МХп 1 ] - меньше, чем системы МХЛ. Следовательно, образование комплекса [ МХп 1 ] - из МХЛ и Х - выгодно энергетически. [57]
Кривая потенциальной энергии взаимодействия двух атомов благородных газов имеет минимум на расстояниях, где дисперсионная сила притяжения точно уравновешивается силой отталкивания, обусловленной перекрыванием замкнутых электронных оболочек. Эту силу обычно называют обменным отталкиванием, она становится значительной тогда, когда имеется достаточное перекрывание двух наборов атомных орбиталей, так что существует большая вероятность обмена между двумя атомами. [58]
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т.е. принадлежащими разным молекулам, напр, в молекулярных кристаллах. Значения ван-дер-ваалъсовых радиусов находят, пользуясь принципом аддитивности А. [59]
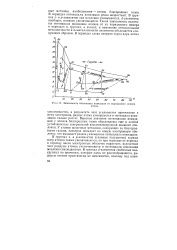 |
Зависимость потенциала ионизации от порядкового номера. [60] |
Страницы: 1 2 3 4 5