Атом - группа
Cтраница 1
Атомы групп V, VI и VII периодической системы имеют валентности соответственно 3, 2 и 1, и в каждом случае насыщение валентности приводит к образованию заполненной октет-ной электронной оболочки. [1]
Атомы групп II и III, по-видимому, проявляют как те, так и другие свойства в зависимости от условий. [2]
Атомы группы II в основном состоянии имеют конфигурацию ( ns) 2, поэтому они в соответствии с табл. 5 ( стр. Как следует из рассуждений в разделе 6.1, это состояние нестабильно. Однако путем возбуждения типа s2 - sp атомы становятся двухвалентными. Именно такую конфигурацию о2я2, очевидно, имеет молекула ВеО, где есть двойная связь, во всем аналогичная связи в этилене, за исключением полярности, возникающей вследствие различия электроотрица-тельностей атомов. Это обусловливает линейность молекулы. Без сомнения, такие структуры вносят свой вклад, но, вероятно, энергетически менее выгодны, чем гибридные структуры. Более того, поскольку центр гибридного зарядового облака находится на некотором удалении от центрального ядра ( см. рис. 8.2), то введением гибридной орбитали учитывается полярность, отображаемая ионной формулой. [3]
Атомы группы III ведут себя во многом таким же образом. В невозбужденном 52р - состоянии они должны быть одновалентны. В этом случае следует ожидать плоского тригонального расположения связей. Действительно, спектроскопические данные и измерения дипольных моментов подтверждают, что молекулы всех трех известных трех-галоидных соединений бора ( BF3, BC13, ВВг3) имеют плоскую-форму. В этих молекулах атом бора содержит во внешнем слое неполный октет электронов и, следовательно, отталкивание между электронами, не спаренными между собой, меньше, чем обычно. Полинг [ 289а ] приводит соображения в пользу того, что укорочение связи достигает 0 09 А. Оно может быть названо поправкой на секстет. [4]
Атомы ЕЛИ группы атомов в многоатомной ашекуле, овязанные с каким-либо атомом который называется; центральным. [5]
Атомы III группы периодической системы элементов - бор, алюминий, галлий, индий - в кремнии и германии являются акцепторами. [6]
Атомам группы I необходимо отдать только 1 электрон, чтобы осталась устойчивая оболочка инертного газа. Энергетически это очень легко, если имеется акцептор электронов. Поэтому натрий и калий исключительно активны, и их обычно хранят под слоем неактивного масла, например минерального масла. Атомы группы VII служат хорошими акцепторами электронов. [7]
Для атомов группы Pd интерпретация экспериментального материала затрудняется, так как начинаются заметные отклонения от LS-связи. Для большинства атомов группы Pt имеет место промежуточный тип связи, поэтому расчет должен проводиться с одновременным учетом электростатического и спинно-орбитального взаимодействия. Ряд расчетов, выполненных за последние годы, показывает, что и в этих случаях взаимодействие конфигураций играет важную роль, причем введение эмпирической поправки aL ( L - - 1) существенно улучшает результаты. [8]
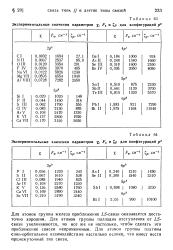 |
Экспериментальные значения параметров, рг и. / для конфигураций /. 2.| Аля конфигураций р9. [9] |
Для атомов группы железа приближение / 5-связи оказывается достаточно хорошим. Для атомов группы палладия отступления от LS-связи увеличиваются, но все же не настолько, чтобы сделать это приближение совсем неприменимым. Для атомов группы платины спин-орбитальное взаимодействие настолько велико, что имеет место промежуточный тип связи. [10]
Адсорбция атома V группы происходит, по-видимому, следующим образом ( см. работу Ландера и Моррисона [252]): атом образует химические связи с тремя соседними поверхностными атомами кремния, а оставшиеся два электрона этого атома о б-разуют ги бриди зованное состояние оборванной - связи. По такой схеме происходит, например, адсорбция атомов фосфора. Аналогичная ситуация имеет место и при адсорбции алюминия, являющегося элементом III группы, с той лишь разницей, что - гиб-ридизованное состояние оборванной связи у этого атома остается незаполненным. Межатомное ( расстояшщ в таком мостике равно межатомному расстоянию в молекуле, хотя углы между связями имеют другое значение. В действительности атом может расположиться над тремя поверхностными атомами двумя различными способами. В первом случае адсорбированный атом располагается прямо над поверхностным атомом, а во втором случае - сбоку от него. Kipowe того, тот факт, что нецентральная силовая постоянная С значительно меньше центральной силовой постоянной С0 ( это особенно проявляется в ионных полупроводниках), показывает, что на поверхности полупроводника энергетически наиболее выгодным типом деформации является изменение углов между связями. [11]
В атомах группы железа, лантанидов и актинидов происходит достройка глубоких d - и f - состояний. Однако это отнюдь не строгий закон, так как в некоторых случаях при образовании химических соединений электроны из глубоких состояний переходят во внешние и начинают участвовать в валентности. Особенно отчетливо это проявляется у некоторых актинидов. Поэтому химические свойства элементов с особыми свойствами групп довольно сложны. [12]
 |
Схема электронных связей в структуре алмаза.| Искажение решетки четырехвалентного германия, вызванное. [13] |
В рассмотренном случае атом V группы является донором. [14]
В идеальном случае все атомы индексной группы должны соприкасаться с катализатором, хогя и не обязательно одновременно. Подтверждение этого мы видим в реакциях дегидрогенизации углеводородов. Очевидно, что и при дегидрогенизации все эти атомы должны соприкасаться с никелем. Как показывает исследование с применением метода меченых атомов ( дейтерообмен и гидрирование дейтерием), реализующие атомы водорода и олефина адсорбируются в определенной последовательности, образуя так называемую полугидрированную форму и атомы водорода, адсорбированные на поверхности ( см. гл. [15]
Страницы: 1 2 3 4