Взаимодействующий атом
Cтраница 1
Взаимодействующие атомы при этом превращаются в ионы. Один из атомов, присоединивший к себе один или несколько электронов, приобретает отрицательный заряд и становится отрицательным ионом. Другой атом, который отдает соответствующее число электронов, превращается в положительный ион. Между разноименно заряженными ионами возникают силы электростатического притяжения. [1]
Когда взаимодействующие атомы отличаются по своей электроотрицательности, то обобществленная пара электронов смещается к более электроотрицательному атому, вызывая появление на последнем отрицательного заряда. Более электроположительный атом, лишившись частично своего электрона, приобретает некоторый положительный заряд, равный по величине отрицательному. [2]
Если взаимодействующие атомы характеризуются различной электроотрицательностью, то обобществленная пара электронов смещается к ядру более электроотрицательного атома. Например, электроотрицательность фтора ( 4 0) больше электроотрицательности водорода ( 2 1), поэтому обобществленная электронная пара в молекуле HF смещена в сторону фтора. Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью. [3]
Если взаимодействующие атомы характеризуются различной электроотрицательностью, то обобществленная пара электронов смещается к ядру более электроотрицательного атома. Например, электроотрицательность фтора ( 4 0) больше электроотрицательности водорода ( 2 1), поэтому обобществленная электронная пара в молекуле HF смещена в сторону фтора. Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной к о в а-лентнойсвязью. [4]
Если взаимодействующие атомы имеют различную электроотрицательность ( атомы разных элементов), то общая электронная пара смещена к атому с большей электроотрицательностью. В этом случае возникает полярная ковалентная связь. Например, полярной является связь в молекуле фтороводорода HF. Общая электронная пара расположена несимметрично относительно центров взаимодействующих атомов. [5]
Расположение взаимодействующих атомов или молекул данного вещества, соответствующее мнним. При низких темп - pax и внешних давлениях она имеет устойчивую форму. При более высоких давлениях и темп - pax устойчивой формой может оказаться иная решетка, соответствующая минимуму термодинамич. [6]
Расположение взаимодействующих атомов или молекул данного вещества, соответствующее миним. При низких темп - pax и внешних давлениях она имеет устойчивую форму. При более высоких давлениях и темп - pax устойчивой формой может оказаться иная решетка, соответствующая минимуму термодинамич. [7]
 |
Схема МО молекул N2, O2, F2 и т. д., получения упрощенным методом. [8] |
Каждый из взаимодействующих атомов имеет в валентной группе одну s - и три р-орбитали. Если расположить ядра атомов вдоль оси z, то орбитали рх и ру обоих атомов взаимодействуют, давая две п-связывающие и две я - разрыхляющие МО. [9]
Колебания сильно взаимодействующих атомов можно представить как совокупность слабо взаимодействующих волн. [10]
Расстояние между взаимодействующими атомами является функцией радиусов соответствующих слоев и расстояний между осями их цилиндров. [11]
Если между взаимодействующими атомами нет других атомов цепи или молекул растворителя, то е определяется поляризуемостями взаимодействующих атомов и реактивным полем окружающей среды. [12]
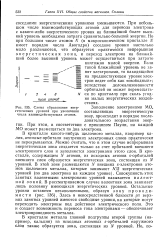 |
Схема образования энер - Заполнение электронами МО. [13] |
При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. [14]
 |
Схема образования энсрге - Заполнение электронами МО. [15] |
Страницы: 1 2 3 4