Кривая - зависимость - скорость - реакция
Cтраница 1
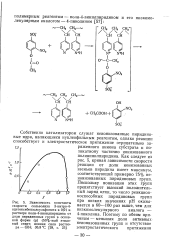
Кривая зависимости скорости реакции от рН ( рис. 13) отчетливо распадается на четыре участка. [1]
 |
Зависимость скорости реакции от времени. [2] |
Кривая зависимости скорости реакции от времени графически изображена на рис. 17.1. Наибольшую скорость реакция имеет в начальный момент, а в дальнейшем по мере уменьшения реагирующих веществ скорость реакции падает. Такая зависимость скорости реакции от времени характерна для реакций любого порядка, протекающих изотермически и подчиняющихся законам классической химической кинетики. Скорость химических реакций в большой степени зависит от температуры, резко возрастая с ее увеличением. [3]
Кривая зависимости скорости реакции от кислотности среды, как правило, носит колоколообразный вид. [4]
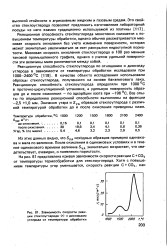 |
Зависимость скорости реакции стеклоуглерода - ( г с диоксидом углерода от температуры обработки. [5] |
На рис. 81 представлена кривая зависимости скорости реакции С - СО2 от температуры термообработки для стеклоуглерода. [6]
На рис. 125 графически изображена кривая зависимости скорости реакции от времени. Наибольшую скорость реакция имеет в начальный момент, и в дальнейшем, по мере уменьшения реагирующих веществ, скорость реакции прогрессивно падает. Такая зависимость скорости реакции от времени характерна для реакций любого порядка, протекающих изотермически и подчиняющихся законам классической химической кинетики. [7]
Как следует из рис. 5, кривая зависимости скорости реакции от доли ионизованных звеньев пиридина имеет максимум, соответствующий примерно 75 %: неионизованных пиридиновых групп. Поскольку ионизации этих групп препятствует высокий положительный заряд цепи, то число реакцион-носпособных пиридиновых групп при низких значениях рН оказывается в 60 - 100 раз выше, чем для низкомолекулярного аналога - 4-пиколина. [9]
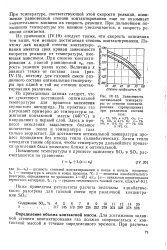 |
Зависимость оптимальной температуры от степени контактирования ( превращения при различном составе газа. [10] |
Поэтому для каждой степени контактирования имеется своя кривая зависимости скорости реакции от температуры, име - IT. При степени контактирования х, равной равновесной хр, скорость реакции равна нулю. Величина х зависит также от состава газа ( рис. IV-15), поэтому для газовой смеси различного состава оптимальные температуры при одной и той же степени контак - тированяя различны. [11]
Для определения оптимальной концентрации кофактора следует построить кривую зависимости скорости реакции от концентрации кофактора, аналогичную зависимости скорости реакции от концентрации субстрата, и по этой кривой выбрать насыщающую концентрацию кофактора. [12]
Если структура соединения неизвестна, для него необходимо построить кривую зависимости скорости реакции от времени. С этой целью проводят серию опытов с различным временем выдержки. В табл. 12 приведено время, необходимое для окисления некоторых соединений. [13]
У аллостерических ферментов, состоящих из нескольких субъединиц [213 - 215], кривая зависимости скорости реакции от концентрации субстрата имеет характерный сигмондный вид. Такой фермент независимо от наличия субстрата имеет две различные конформации, находящиеся в равновесии. Связывание эффектора происходит на одной из субъединиц в аллостерическом центре, пространственно отделенном от места связывания субстрата, и вызывает конформационные изменения других субъединиц. Фермент активируется, если эффектор является активатором, и ингнбируется, если с алло-стерическим центром связывается ингибитор. Аллостерические ферменты обычно участвуют в контроле первых ступеней мультиферментных цепей. [14]
Опыты по окислению разбавленного азотом метана показывают, что скорость реакции увеличивается с увеличением парциального давления инертного газа; однако кривая зависимости скорости реакции от давления инертного газа имеет нисходящий характер, как и следует ожидать в случае, если а и Ь увеличиваются с повышением давления. [15]
Страницы: 1 2