Кривая - зарядка
Cтраница 1
Кривая зарядки показывает, что от 1 5 в ( начального напряжения заряженного аккумулятора) напряжение при дальнейшем заряжении, необходимом для окисления всей закиси никеля и восстановления всей закиси железа, поднимается до 1 8 в. При разрядке, однако, напряжение сразу падает до 1 5 в, а потом понижается более медленно. Эксплуатация аккумулятора идет в среднем при 1 23 в; по достижении напряжения, равного 1 в, работу прерывают, так как в дальнейшем наступает уже очень быстрое падение напряжения. Большое расхождение между кривыми зарядки и разрядки объясняется тем, что при первом процессе высший потенциал обусловливается побочным процессом выделения обильно образующегося водорода на катоде, так как основная реакция восстановления закиси железа идет очень медленно. Другой причиной повышения потенциала является образование NiC2, который затем разлагается без всякой пользы, не выделяя электрической энергии. [1]
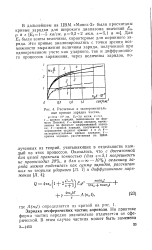 |
Расчетные и экспериментальные кривые зарядки частиц. [2] |
Потенье; 2 - кривая зарядки, вычисленная по формуле диффузионной заряд-кк; 3 - кривая зарядки, полученная суммированием ординат кривых 1 и 2; 4 - экспериментальная кривая зарядки; 5 - кривая зарядки, рассчитанная на ЦВМ. [3]
Можно считать, что кривая зарядки конденсатора Сх или С2 совпадает по форме с кривой напряжения на зажимах вторичной обмотки трансформатора, а разрядка конденсатора начинается с того момента, когда напряжение на вторичной обмотке трансформатора достигает наибольшего значения. [4]
Анализ просчитанных на ЦВМ кривых зарядки показывает, что в общем случае величина заряда частицы может быть приближенно определена как сумма зарядов, вычисленных по теориям ударного и. [5]
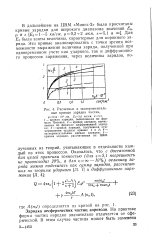 |
Расчетные и экспериментальные кривые зарядки частиц. [6] |
Потенье; 2 - кривая зарядки, вычисленная по формуле диффузионной заряд-кк; 3 - кривая зарядки, полученная суммированием ординат кривых 1 и 2; 4 - экспериментальная кривая зарядки; 5 - кривая зарядки, рассчитанная на ЦВМ. [7]
С помощью газокинетических методов можно определить величину потока ионов, попадающих на частицу, после чего построить кривую зарядки частицы во времени, которую следует трактовать как кривую изменения во времени средней величины заряда большого количества монодисперсных частиц. [8]
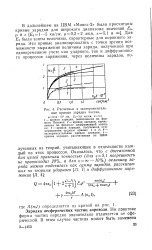 |
Расчетные и экспериментальные кривые зарядки частиц. [9] |
Потенье; 2 - кривая зарядки, вычисленная по формуле диффузионной заряд-кк; 3 - кривая зарядки, полученная суммированием ординат кривых 1 и 2; 4 - экспериментальная кривая зарядки; 5 - кривая зарядки, рассчитанная на ЦВМ. [10]
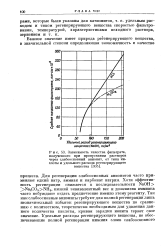 |
Зависимость качества фильтрата, полученного при пропускании растворов через слабоосновный анионит, от типа кислоты и удельного расхода регенерирующего вещества. [11] |
Для регенерации слабоосновных анионитов часто применяют едкий натр, аммиак и карбонат натрия. Хотя эффективность регенерации снижается в последовательности NaOH Na2C03NH3, низкий эквивалентный вес и дешевизна аммиака часто побуждают отдать предпочтение именно этому реагенту. Так как слабоосновные аниониты требуют для полной регенерации лишь незначительный избыток регенерирующего вещества по сравнению с количеством, теоретически необходимым для удаления данного количества кислоты, кривая зарядки ионита теряет свое значение. [12]
Кривая зарядки показывает, что от 1 5 в ( начального напряжения заряженного аккумулятора) напряжение при дальнейшем заряжении, необходимом для окисления всей закиси никеля и восстановления всей закиси железа, поднимается до 1 8 в. При разрядке, однако, напряжение сразу падает до 1 5 в, а потом понижается более медленно. Эксплуатация аккумулятора идет в среднем при 1 23 в; по достижении напряжения, равного 1 в, работу прерывают, так как в дальнейшем наступает уже очень быстрое падение напряжения. Большое расхождение между кривыми зарядки и разрядки объясняется тем, что при первом процессе высший потенциал обусловливается побочным процессом выделения обильно образующегося водорода на катоде, так как основная реакция восстановления закиси железа идет очень медленно. Другой причиной повышения потенциала является образование NiC2, который затем разлагается без всякой пользы, не выделяя электрической энергии. [13]
Страницы: 1