Кривая - распределение - молекула
Cтраница 2
В реальных дисперсных системах частицы имеют различные размеры. Распределение частиц по размерам описывается кривыми, аналогичными кривым распределения молекул газа п & энергиям или скоростям. [16]
В любых дисперсных системах, как правило, частицы не обладают одинаковыми размерами; наряду с частицами того размера, которые содержатся в наибольшем количестве, всегда встречаются частицы более крупные и более мелкие. Распределение частиц по размерам представляется обычно кривыми, в общем аналогичными кривым распределения молекул газа по скоростям ( рис. 7, стр. [17]
В любых дисперсных системах, как правило, частицы не обладают одинаковыми размерами; наряду с частицами того размера, которые содержатся в наибольшем количестве, всегда встречаются частицы более крупные и более мелкие. Распределение частиц по размерам представляется обычно кривыми ( рис. 127), в общем аналогичными кривым распределения молекул газа по скоростям. [18]
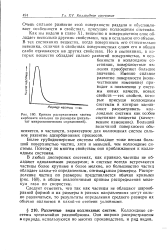 |
Кривая распределения частиц лоидные системы как особое. [19] |
В любых дисперсных системах, как правило, частицы не обладают одинаковыми размерами; в системе всегда встречаются частицы более крупные и более мелкие, но большинство частиц обладает каким-то определенным, оптимальным размером. Распределение частиц по размерам представляется обычно кривыми ( рис. 160), в общем аналогичными кривым распределения молекул газа по скоростям. [20]
 |
Кривые распределения молекул по скоростям при TiT2 и Т2Т3. [21] |
С повышением температуры газа максимум кривой смещается в сторону больших скоростей, а его абсолютная величина уменьшается. Таким образом, при нагревании газа доля молекул, движущихся с малыми скоростями, уменьшается, а доля молекул, обладающих большими скоростями увеличивается. Скорость мм, отвечающая максимуму кривой распределения молекул по скоростям, называется наиболее вероятной. [22]
 |
Проекция траектории движения отдельной молекулы на плоскость ( р 0 8 кг / дм3, Т 500 К. [23] |
Для удобства сравнения с экспериментальными результатами расчетные Р - V - Г - данные определялись по изохорам. Исследования показали, что переход ее от неравновесного к равновесному состоянию происходит за 150 - 200 шагов интегрирования при величине шага A t 0 3 - 10 - 14 сек, что подтверждает соответствующую гипотезу Больцмана. Критерием достижения равновесия может служить вид распределения молекул по скоростям. Можно считать, что система находится в состоянии равновесия, если распределение молекул по скоростям близко к максвелловскому. На рис. 1 представлен типичный вид кривой распределения молекул по скоростям. [24]
Страницы: 1 2