Кривая - растворимость
Cтраница 3
Кривая растворимости изгибается, растворимость достигает минимума и может вновь начать расти. [31]
Кривая растворимости может быть определена визуально-политермическим методом, сущность которого заключается в измерении температуры появления первого кристаллика твердой фазы - при охлаждении и его исчезновении - при нагревании, в условиях непрерывного размешивания. При некотором опыте этот метод дает точные результаты для определения ликвидуса, однако лишь когда равновесие устанавливается достаточно быстро. В случае кристаллизации твердых растворов этот метод обычно дает температуры плавления, отличающиеся от получающихся изотермическим методом, особенно при быстром охлаждении. Значительным недостатком этого метода является также невозможность непосредственного установления состава твердой фазы, находящейся в равновесии с данной жидкостью. [32]
Кривая растворимости мета-вольфрамата калия была изучена до 80; в пределах температур от 0 до 86 существуют четыре различные твердые фазы. [33]
Кривая растворимости представляет собой на этом участке линию, параллельную оси абсцисс, и характеризует образование основных солей индия. Выпадение осадка начинается только после прибавления 2 6 эквивалента щелочи. Осадок в этой точке отстаивается и фильтруется чрезвычайно медленно. [34]
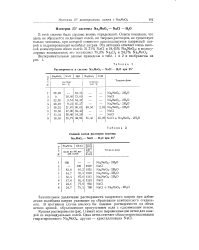 |
Растворимость в системе Na2Mo04 - NaCl - Н20 при 25. [35] |
Кривая растворимости ( рис. 1) имеет ясно выраженные две ветви для каждой из индивидуальных солей. [36]
Кривая растворимости на таких диаграммах аналогична кривой ликвидуса на диаграммах конденсированных систем. [37]
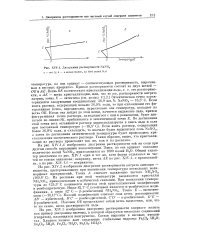 |
Диаграммы растворимости NaN03 а - вес. %. б - в молях NaNO3 на 1000 молей Н О. [38] |
Кривая растворимости состоит из двух ветвей - QE и АЕ. АЕ - ветвь кристаллизации, или, что то же, растворимости нитрата натрия; точка Е - эвтектика ( см. раздел VI.2.) Эвтектическая точка характеризуется следующими координатами: 36 9 вес. Если взять раствор, содержащий меньше 36 9 % соли, то при охлаждении его фигуративная точка, передвигаясь параллельно оси температур, попадает на ветвь ОЕ. Если взять раствор, содержащий более 36 9 % соли, и охлаждать, то вначале будет выделяться соль NaN03, а затем по достижении эвтектической температуры будет происходить кристаллизация эвтектического раствора. Таким образом, видно, что кристаллизация из раствора происходит так же, как и из расплава. [39]
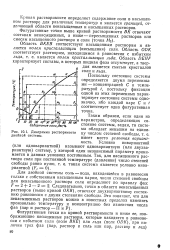 |
Диаграмма растворимости цу числом степеней свободы, т. е. двойной системы. имеет место условная вариант. [40] |
Кривая растворимости определяет содержание соли в насыщенном растворе для различных температур и является границей, отделяющей области ненасыщенных и насыщенных растворов. [41]
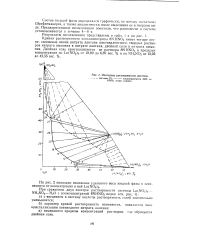 |
Изотермы растворимости системы. [42] |
Кривая растворимости изоконпентраты 8N HN03 имеет четыре ветви: сплошные линии нитрата лантана шестивалентного, твердых растворов нитрата аммония в нитрате лантана, двойной соли и нитрата аммония. Двойная соль кристаллизуется из раствора 8N HNO3 в пределах концентрации по La ( NO3) 3 от 10 80 до 6 89 вес. [43]
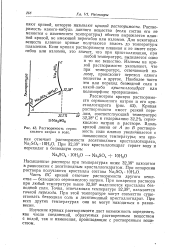 |
Растворимость сернокислого натрия в воде. [44] |
Кривая растворимости имеет резкий пере-лом, соответствующий температуре 32 38 С и содержанию 32 2 % сернокислого натрия в растворе. [45]
Страницы: 1 2 3 4 5