Кривая - скорость - реакция
Cтраница 1
Кривая скорости реакции, протекающей при 16 С, состоит из двух участков, один из которых описывается уравнением первого порядка и характеризует быструю стадию процесса, а второй - относится к следующей медленной стадии, протекающей по уравнению нулевого порядка. [1]
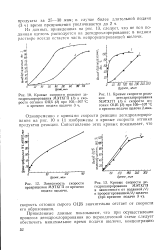 |
Кривые скорости реакции де - [ IMAGE ] Кривые скорости реак.| Кривые скорости дегидрохлорирования МЭТХГП в зависимости от поданной ( I и прореагировавшей щелочи ( при времени подачи 3 ч. [2] |
Одновременно с кривыми скорости реакции дегидрохлорирования на рис. 10 и И изображены и кривые скорости отгонки продуктов реакции. [3]
До этого изменения механизма кривая скорости реакции может быть и неправильной, но после него она должна только возрастать. [4]
На исследуемую смесь действуют гидрохлоридом гидроксил-амина и определяют количество прореагировавшего соединения через последовательные промежутки времени. По полученным данным строят кривую скорости реакции второго порядка. Если карбонильные соединения смеси реагируют с различной скоростью, кривая состоит из двух прямолинейных отрезков. [5]
Он нашел, что растворы тех кислот, которые энергичнее реагируют с магнием, проводят лучше электрический ток. Что же касается растворов каждой из кислот в отдельности, то налицо сходство между концентрационными кривыми электропроводности и кривыми скорости реакции. Безводные кислоты не растворяют магний и не проводят тока. Наибольшей химической активностью обладают частицы кислот в наиболее разбавленных растворах. Молярная электропроводность растворов кислот также увеличивается при разбавлении раствора. Природа растворителя оказывает сходное влияние на химическую энергию тел и электропроводность их растворов. [6]
Влияние стенок на скорость реакции существенно зависит от их природы и способа обработки перед реакцией. Мытье сосуда раствором NaCl замедляло реакцию настолько, что нужно было почти на 100 повысить температуру, чтобы получить прежнюю кривую скорости реакции. [7]
 |
Относительная скорость бромирования ненасыщенных соединенш. [8] |
Реакцию гидрирования проводят в присутствии катализатора; отмечают уменьшение содержания водорода в реакционной системе со временем. Поскольку водород находится в большом избытке по отношению к анализируемым соединениям, реакцию можно рассматривать как процесс псевдопервого порядка. Кривая скорости реакции первого порядка состоит из двух прямолинейных отрезков, соответствующих обоим ненасыщенным соединениям в смеси. [9]
Обычно такое превращение соответствует кажущейся энергии активации. Однако бывают случаи, когда кривая скоростей реакции в зависимости от температуры сильно меняет свой вид. [10]
Соответствие зависимостей скорости реакции и электропроводности смеси обусловлено тем, что медь устойчива в одновалентном состоянии. Скорость растворения определяется скоростью передачи одного электрона. Затем происходит окисление меди до двухвалентного состояния, но эта реакция не определяет скорости растворения меди. Его обычно получают из смеси четырехокиси азота с этилацетатом ( разд. Кривая скорости реакции для цинка ( рис. 1) имеет тот же характер, что и кривая скорости реакции для меди, но максимум несколько смещен. Максимум на кривой скорости для урана не соответствует максимуму электропроводности. Ни цинк, ни уран не устойчивы в одновалентном состоянии. Реакция этих металлов с N0 имеет высший порядок, и скорость реакции поэтому не должна непосредственно зависеть от его концентрации. Чтобы показать возможность использования инертных разбавителей, в дальнейшем указан метод синтеза безводного нитрата уранила. Этот синтез интересен еще и тем, что в соединении U02 ( N03) 2 - N204 четырехокись азота очень прочно связана с нитратом уранила, и ее можно удалить только при строгом соблюдении условий разложения. [11]
Соответствие зависимостей скорости реакции и электропроводности смеси обусловлено тем, что медь устойчива в одновалентном состоянии. Скорость растворения определяется скоростью передачи одного электрона. Затем происходит окисление меди до двухвалентного состояния, но эта реакция не определяет скорости растворения меди. Его обычно получают из смеси четырехокиси азота с этилацетатом ( разд. Кривая скорости реакции для цинка ( рис. 1) имеет тот же характер, что и кривая скорости реакции для меди, но максимум несколько смещен. Максимум на кривой скорости для урана не соответствует максимуму электропроводности. Ни цинк, ни уран не устойчивы в одновалентном состоянии. Реакция этих металлов с N0 имеет высший порядок, и скорость реакции поэтому не должна непосредственно зависеть от его концентрации. Чтобы показать возможность использования инертных разбавителей, в дальнейшем указан метод синтеза безводного нитрата уранила. Этот синтез интересен еще и тем, что в соединении U02 ( N03) 2 - N204 четырехокись азота очень прочно связана с нитратом уранила, и ее можно удалить только при строгом соблюдении условий разложения. [12]
Страницы: 1