Отрицательно заряженный атом
Cтраница 1
Отрицательно заряженные атомы проявляют эффект с противоположным знаком по сравнению с теми же атомами, но в незаряженном состоянии. Так, ОН-группа в спиртах ROH проявляет - / - - эффект, а отрицательно заряженный атом кислорода в анионах спиртов RO - проявляет - ff - эффект. [1]
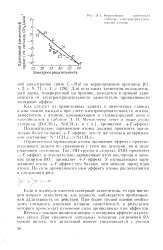 |
Корреляция химических. [2] |
Отрицательно заряженные атомы проявляют эффект с противоположным знаком по сравнению с теми же атомами, но в незаряженном состоянии. Так, ОН-группа в спиртах ROH проявляет - / - - эффект, а отрицательно заряженный атом кислорода в анионах спиртов RO - проявляет - ( - / - - эффект. [3]
Отрицательно заряженный атом галоида в экваториальном изомере XI, расположенный близко к легкополяризуемому атому кислорода карбонильной группы, индуцирует на нем противоположный заряд, одновременно уменьшая свою отрицательность. Это приводит к уменьшению полярности как С-Hal, так и С 0-связей и, в свою очередь, приводит к возрастанию частот, что согласуется с опытом. [4]
C-Эффект проявляют отрицательно заряженные атомы; их эффект также тем больше, чем меньше заряд ядра, п больше, чем тех же атомов в незаряженном состоянии. [5]
BAs имеют отрицательно заряженные атомы металла ( Z 0), а в кристалле ВеО атом металла имеет заряд, близкий к нулю. [6]
Следовательно, отрицательно заряженными атомами в атомных соединениях будут называться такие, к которым смещены электроны общей пары, а положительно заряженными, - от которых эти электроны оттянуты. Отрицательно заряженными можно рассматривать атом углерода в молекуле метана, атом азота в молекуле аммиака, атом кислорода в молекуле воды. Атомы водорода в этих соединениях рассматриваются как положительно заряженные. Ковалентная связь называется неполярной, если электронная пара в равной мере принадлежит обоим атомам, и полярной, когда электронная пара смещена к одному из атомов. В молекулах простых веществ связь неполярная. В молекулах сложных веществ она, как правило, полярная. [7]
Во второй структуре отрицательно заряженный атом фтора находится на том же расстоянии, что и в реальной молекуле HF. Вследствие большого различия в электроотрицательности Н и F вклад ионной структуры значителен. [8]
В тиосульфате имеются отрицательно заряженные атомы серы. Следовательно, данное вещество обладает восстановительными свойствами. [9]
Илиды характеризуются наличием отрицательно заряженного атома углерода, связанного с группой, способной к уходу в виде нуклеофильной частицы. [10]
Если заместитель имеет положительно или отрицательно заряженные атомы, то вокруг них создается электрическое поле, которое действует не только по линии связей, но и непосредственно через пространство; в этом случае сила воздействия заместителя на дрхгие атомы зависит о г конфигурации и конформашш молекулы. Аналогично действуют и заместители, образующие сильнополярные связи С-X. Если в цепи имеется система сопряженных кратных связен, либо заместитель находится при кратной связи или ароматическом ядре, то передача влияния, проходящая по системе л-связей. [11]
Не менее очевидно, что отрицательно заряженные атомы всегда являются донорами электронов, а положительно заряженные - акцепторами электронов. [12]
Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Это обусловлено тем, что обладая ничтожно малыми размерами и, в отличие от других катионов, не имея внутренних электронных слоев, которые отталкиваются отрицательно заряженными атомами, ион водорода ( протон) способен проникать в электронные оболочки других атомов. [13]
АСИММЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА - насыщенный или отрицательно заряженный атом углерода, через к-рый нельзя провести плоскость симметрии. Этому условию удовлетворяет для насыщенного атома углерода тот случай, когда все четыре заместителя, с к-рыми связан этот атом углерода, различны. Для отрицательно заряженного атома углерода ( карбаниона) необходимо, чтобы все три заместителя были различшл. I) атом С по является асимметрич. Если заместить в этиловом спирте атом водорода, стоящий у вторичного атома С, то этот атом С станет асимметрич. В а-дейтеро-этиловом спирте или а-фенилэтиловом спирте ( III) плоскость симметрии отсутствует. [14]
АСИММЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА - насыщенный или отрицательно заряженный атом углерода, через к-рый нельзя провести плоскость симметрии. Для отрицательно заряженного атома углерода ( карбаниона) необходимо, чтобы все три заместителя были различны. I) атом С не является асимметрич. Если заместить в этиловом спирте атом водорода, стоящий у вторичного атома С, то этот атом С станет асимметрич. [15]
Страницы: 1 2 3 4