Кондуктометрическая кривая - титрование
Cтраница 1
 |
Теоретические кривые кон-дуктометрического титрования сильным основанием смесей 0 1 н. раство. [1] |
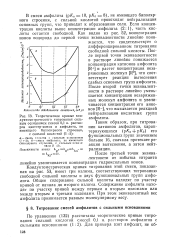
Кондуктометрическая кривая титрования этой смеси, показанная на рис. 53, имеет три излома, соответствующих титрованию свободной сильной кислоты и двух функциональных групп амфолита. Общее содержание сильной кислоты находят по участку кривой от начала до второго излома. Содержание амфолита находят по участку кривой между первым и вторым изломами или между вторым и третьим изломами. При этом эквивалентный вес амфолита принимается равным молекулярному весу. [2]
Кондуктометрическая кривая титрования смеси НС1, СНзСООН и Н3ВО3 раствором NaOH имеет три излома. Сначала нейтрализуется НС1, при этом электропроводность сильно понижается. Кривая титро вания до первой точки эквивалентности имеет слабый изгиб, что объясняется уменьшением силы НС1 в ацетоно-водной среде. Затем последовательно нейтрализуются СН3СООН и Н3ВО3; повышение электропроводности раствора при нейтрализации СН3СООН более сильно выражено, что приводит к появлению второго излома кондуктометриче-ской кривой. При избытке щелочи наблюдается резкое повышение электропроводности раствора. На кондуктометрических кривых графическим методом устанавливают точки эквивалентности и определяют количество интервалов между изломами. Отсчет начинают со второй точки. Десятые доли интервалов вблизи точек эквивалентности определяют на глаз. [3]
Кондуктометрическая кривая титрования л-фенилендиамина характеризуется двумя изломами, соответствующими двум ступеням нейтрализации л-фенилендиамина. По кондуктометрической кривой определяют объем л-толуолсульфокислоты, вступившей в реакцию до второго излома. [4]
Кондуктометрическая кривая титрования смеси НС1, СН3СООН и Н3ВО3 раствором NaOH имеет три излома. [5]
Кондуктометрическая кривая титрования я-фенилендиамина характеризуется двумя изломами, соответствующими двум ступеням нейтра лизации n - фенилендиамина. [6]
По кондуктометрической кривой титрования определяют количество миллилитров титранта, вступившего в реакцию, и проводят вычисления, как описано в гл. [7]
Кондуктометрическим титрованием называют метод определения концентрации или содержания вещества по Кондуктометрическим кривым титрования, которые получают многократным измерением электрической проводимости после каждого прибавления небольшой порции титранта ( 0 1 - 0 2 мл) к титруемому раствору, находящемуся в кондуктометрической ячейке. [8]
Когда соль подвергается полному гидролизу по первой ступени и слабо гидролизована по второй ступени ( р / Са1 4 - - 9), в растворе соли находится сильное основание и кислая соль. Кондуктометрическая кривая титрования такой соли имеет два излома. Первый соответствует нейтрализации сильного основания, образующегося при гидролизе, а второй - вытеснению кислоты из кислой соли. Электропроводность раствора до первого излома понижается, а между первым и вторым изломами мало изменяется и зависит от сравнительной подвижности НАп - - ионов и анионов сильной кислоты. [9]
Метод основан на кондуктометрическом титровании уксусной и минеральной кислот ( соляной или серной) щелочью, уксуснокислого натрия - соляной кислотой. На кондуктометрической кривой титрования кислот первый излом кривой соответствует точке эквивалентности минеральной кислоты, второй - точке эквивалентности суммы мийеральной и уксусной кислот. [10]
Подвижность катионов этой соли выше подвижности катионов натрия, поэтому после некоторого понижения электропроводности раствора в начале титрования электропроводность и дальше продолжает понижаться, но менее заметно. Если же подвижность катионов соли ниже подвижности катионов титранта, кондуктометрическая кривая титрования соли имеет пологий минимум, не отвечающий какой-либо характерной для анализа точке. [11]
 |
Кондуктометрические кривые титрования солей слабых оснований раствором NaOH ( кривые а, б, s з, к, л и солей слабых кислот раствором НС1 ( кривые г, д, е, ж, и, м. [12] |
Подвижность катионов этой соли выше подвижности катионов натрия, поэтому после некоторого понижения электропроводности раствора в начале титрования электропроводность и дальше продолжает понижаться, но менее заметно. Если же подвижность катионов соли, ниже подвижности катионов титранта, кондуктометрическая кривая титрования соли имеет пологий минимум, не отвечающий какой-либо характерной для анализа точке. [13]
Некоторые особенности наблюдаются при титровании цианидов. Сначала образуются комплексные [ Ag ( CN) 2 ] - - ионы, что приводит к понижению электропроводности раствора. После окончания процесса комплексообразова-ния кондуктометрическая кривая титрования имеет излом. Затем происходит осаждение AgCN, что сопровождается повышением электропроводности раствора до точки эквивалентности. Более сильное повышение электропроводности наблюдается после точки эквивалентности. Характерное поведение цианидов используется при анализе их смесей с хлоридами. [14]
После точки эквивалентности концентрация Ап - остается постоянной, а концентрация Kt продолжает увеличиваться. Характерная особенность нейтрализации слабых кислот заключается в том, что концентрация ионов водорода на протяжении всего процесса титрования настолько мала, что не оказывает заметного влияния на электрическую проводимость раствора. Концентрация гидроксилъных ионов также невелика до точки эквивалентности, а после нее линейно повышается. Точка эквивалентности расположена па пересечении двух восходящих ветвей кондуктометрической кривой титрования. Такой характер имеют кривые титрования всех слабых кислот ( рКдис равно 5 - 9), при нейтрализации которых гидролиз получающихся солей не оказывает существенного влияния на процесс нейтрализации. При титровании очень слабых кислот ( рКдис 9), соли которых в значительной степени гидролизуются в водных растворах, концентрация гидроксилъных ионов вследствие гидролиза начинает увеличиваться раньше, чем будет достигнута точка эквивалентности. Так как подвижность ионов OtT высока, электрическая проводимость раствора вблизи точки эквивалентности увеличивается и кривая титрования закругляется. [15]
Страницы: 1 2