Емкостная кривая
Cтраница 1
Емкостные кривые на расплавленных свинце, кадмии, алюминии, сурьме, серебре, таллии, висмуте, индии, галлии и теллуре в расплаве КС1 - NaCl имеют форму параболы с симметричными ветвями. [1]
Емкостная кривая имеет три пика: два соответствуют потенциалам полуволн предволны и основной волны подпрограммы и третий пик - при Е - - 0 8 в. Частотная зависимость пиков псевдоемкости реакции и соответствующих им пиков проводимости аналогична частотной зависимости составляющих импеданса электрода в растворе рибофлавина. Так как ctg 1 во всем экспериментально доступном диапазоне частот ( 200 - 5000 рад / сек), уменьшение угла сдвига фаз означает медленность адсорбции компонентов реакции или различие в адсорбиру-емости юглона и гидроюглона. Медленность адсорбции юглона следует также из хронопотен-циометрических измерений. Емкостный пик при Е - - 0 8 в практически не зависит от частоты и является пиком десорбции гидроюглона, что соответствует данным хронопотенцио-метрии. [2]
Получены емкостные кривые для ряда жидких металлов: свинца, кадмия, олова, алюминия, сурьмы, серебра, таллия, висмута, индия, галлия и теллура, а также для твердых алюминия, магния и серебра. В большинстве измерений электролитом служила расплавленная эквимолярная смесь КС1 - NaCl. [3]
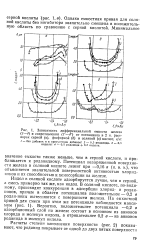 |
Зависимость дифференциальной емкости железа ( 1 - 4 и сопротивления ( / - 4 от потенциала в 2 н. растворах серной ( а, фосфорной ( б и соляной ( в кислот, г / л. [4] |
Однако емкостная кривая для соляной кислоты без ингибитора значительно смещена в положительную область по сравнению с серной кислотой. [5]
Форма емкостных кривых также не соответствовала теоретически рассчитанной. Все эти факты указывают, что в. Как видно из сравнения кривых рис. 9, наиболее низкие значения емкости в анодной области наблюдаются для n - германия с высоким удельным сопротивлением, а наиболее высокие - для низкоомного р-германия. Объяснить полученные экспериментальные результаты можно только в том случае, если учесть влияние внешнего электрического поля, которое на л-германии будет оттягивать основные носители - электроны - от границы раздела с электролитом, а на р-германии - отталкивать дырки к поверхности электрода. В анодной области электрод из р-германия должен вести себя так же, как и из вырожденного германия, не обладающего полупроводниковыми свойствами. Протекающая при высоких анодных потенциалах электрохимическая реакция растворения германия оказывает значительное влияние на дифференциальную емкость электрода, вызывая появление псевдоемкости, а также характерных максимумов и минимумов, связанных с окислением поверхности электрода. [6]
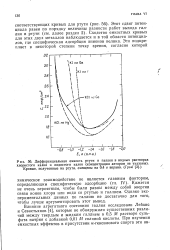 |
Дифференциальная емкость ртути и галлия в водных растворах. [7] |
Сходство емкостных кривых для этих двух металлов наблюдается и в той области потенциалов, где специфическая адсорбция анионов велика. [8]
Горб на емкостных кривые чаще всего наблюдается в случае третьего тина адсорбции, но он имеется также в отсутстште какой бы то пи было заметной адсорбции, как, например, в случае водного раствора IS aF при температурах ниже комнатной. На рис. 3 показан ряд типичных результатов, полученных после вычитания емкости диффузного двойного слоя. [9]
Высота пика на емкостной кривой пропорциональна логарифму концентрации сульфида ( в интервале 10 - 4 - 10 - 2М) ж обратно пропорциональна корню квадратному. [10]
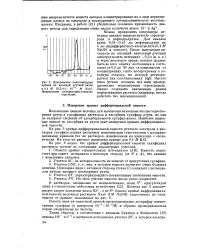 |
Циклическая вольтамперная кривая на висящей ртутной капле. [11] |
Высота пика на емкостной кривой пропорциональна логарифму концентрации сульфида ( в интервале 10 - 4 - 10 - 2М) и обратно пропорциональна корню квадратному из частоты. [12]
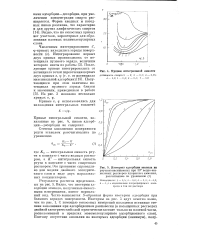 |
Кривые интегральной емкости.| Изотермы адсорбции этанола на. [13] |
Видно, что на емкостных кривых нет участков, характерных для образования плотных полимолекулярных слоев. [14]
Оставляя в стороне детали емкостных кривых, обратим внимание на главное: как при низких ( рис. 4), так и при высоких концентрациях иодид-иона ( рис. 5) их адсорбция не составляет непреодолимого препятствия для адсорбции дитропила: в широком интервале потенциалов на емкостных кривых наблюдается депрессия, обусловленная, как и прежде, адсорбцией дитропила. [15]
Страницы: 1 2 3 4 5