Кристалл - ангидрит
Cтраница 2
Однако практически такой переход наблюдается лишь в присутствии в водной среде кристаллов ангидрита. При 370 К и выше CaSO4 - 2H2O в водной среде переходит в а-полугидрат, который в указанной темпера-турной области менее раство-рим, чем двугидрат, что обус-ловливает его стабильность. Характерно, что образование при этом наименее растворимого и поэтому наиболее стабильного ангидрита в отсутствие кристаллических затравок практически не наблюдается. [16]
С повышением температуры дегидратация полугидрата ускоряется, и соответственно уменьшаются размеры кристаллов ангидрита. Это, вероятно, объясняется увеличением скорости растворения полугидрата при повышении температуры и достижением в результате этого большего пересыщения раствора сульфатом кальция. При 120 в растворе, содержащем 3 - 3 5 % H2S04, продолжительность процесса меньше в 2 - 3 раза, чем при 100, и составляет 30 - 40 мин вместо 80 - 120 мин. [17]
Последний затем обрабатывают серной кислотой с выделением полугидрата, который в присутствии затравки кристаллов ангидрита перекристаллизовывают в дегидраторе в хорошо фильтрующий ангидрит. [18]
Последний затем обрабатывают серной кислотой с выделением полугидрата, который в присутствии затравки кристаллов ангидрита церекристаллизовывают в дегидраторе в хорошо фильтрующий ангидрит. [19]
С повышением температуры дегидратация полугидрата сульфата кальция ускоряется, и соответственно уменьшаются размеры кристаллов ангидрита. Это, вероятно, объясняется увеличением скорости растворения полугидрата при повышении температуры и достижением в результате этого большего пересыщения раствора сульфатом кальция. При 120 в растворе, содержащем 3 - 3 5 % H2SO4, продолжительность процесса меньше в 2 - 3 раза, чем при 100, и составляет 30 - 40 мин вместо 80 - 120 мин. [20]
Таким образом, свойства высокообожженного ангидритового вяжущего определяются, во-первых, явлениями нарушения молекулярной структуры кристаллов искусственного ангидрита, что облегчает последующую, хотя и замедленную гидратацию; во-вторых, образованием существенного количества основного сульфата. [21]
Через 30 мин после добавления воды полугидрат переходит в очень мелкие иглообразные ( в виде палочек) кристаллы ангидрита. В поле зрения не обнаруживается ни одного крупного кристалла гипса. Через 60 - 90 мин твердая фаза пульпы состоит целиком из ангидрита. [22]
Нулевая фракция, оставшаяся в агитаторе, содержит много крупных зерен ( размером от 90 до 200и) апатита и минералов, входящих в состав апатитового концентрата, а также значительное количество более мелких зерен апатита ( 20 - 50и) и очень много шламистых кристаллов ангидрита. [23]
Кристаллы ангидрита имеют таблитчатую или призматическую форму. [24]
Дальнейшее уменьшение содержания серной кислоты в растворе до 2 - 1 % H2SO4 связано с уменьшением нормы ее до 100 и 90 % по отношению к стехиометрическому количеству ( в расчете на кальций) и накоплением в растворе ионов кальция. В этом случае выделяются мелкие и неразвитые по форме кристаллы ангидрита, хотя фазовый переход протекает очень медленно. Для полного превращения полугидрата в ангидрит в этом случае требуется в зависимости от нормы кислоты от 150 до 600 мин. [25]
Как видно из табл. 9, при прочих равных условиях ( концентрация, норма кислоты и Т: Ж) температура является одним из факторов, определяющих скорость фазового перехода сульфата кальция в растворе. При повышенных температурах ( 70 - 80 С) через 80 - 90 мин твердая фаза пульпы представлена преимущественно кристаллами ангидрита. Замедление фазового перехода полугидрата в гипс, с образованием в качестве промежуточной твердой фазы ангидрита, является причиной накопления значительного количества мелких кристаллов ангидрита. [26]
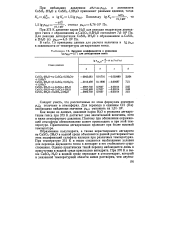 |
Значение коэффициентов в уравнении Для дегидратации гипса. [27] |
Образование полугидрата, а также нерастворимого ангидрита из CaSO4 - 2H2O в водной среде объясняется разной растворимостью этих модификаций сульфата кальция при различных температурах. При температуре 315 К и выше создаются необходимые условия для перехода двуводного гипса в ангидрит и его стабильного существования. Однако практически такой переход наблюдается лишь в присутствии в водной среде кристаллов ангидрита. [28]
При высоком содержании ангидрита в пласте соли, растворяемой в воде, часть его остается в скважине в виде нерастворимого шлама, оседающего на дно. Это способствует увеличению расхода химикатов и содержания в очищенном рассоле сульфат-иона, если в дальнейшем не осаждать его хлористым кальцием или барием. Для снижения скорости растворения загрязняющих поваренную соль примесей кальциевых соединений предложено [10-13] добавлять к воде, подаваемой на растворение, пирофосфат, гексаметафосфат, трипо-лифосфат или карбонат натрия. Предполагается, что при этом на поверхности кристаллов ангидрита или других кальциевых соединений отлагается осадок малорастворимых соединений, препятствующих растворению солей кальция. Насколько эти предложения могут быть эффективными при подземном растворении соли в течение продолжительного контакта раствора с пластом, трудно судить. [29]
Страницы: 1 2