Гидроксильный атом - водород
Cтраница 1
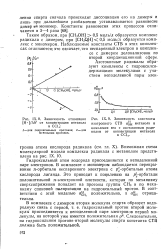 |
Зависимость отношения [ IMAGE ] IX. 9. Зависимость константы [ Я - ] / ДЯ от концентрации метанола изотропного СТВ о. н метанола в. [1] |
Гидроксильный атом водорода присоединяется к неподеленной паре электронов. В комплексе с мономером наблюдается перекрывание л-орбитали неспаренного электрона с р - орбиталью атома кислорода лиганда. Это приводит к появлению на р - орбитали положительной я-электронной плотности, которая по механизму сверхсопряжения попадает на протоны группы СН3 и по механизму спиновой поляризации на гидроксильный протон. [2]
Гидроксильный атом водорода у I подвижен и может обмениваться на другие атомы шги группы, что дает возможность, в частности, перейти от I к гетероциклическим соединениям. [3]
Гидроксильный атом водорода у I подвижен и может обмениваться на другие атомы или группы, что дает возможность, в частности, перейти от I к гетероциклическим соединениям. [4]
После того как гидроксильный атом водорода замещен действием реактива Гриньяра на группу - MgX, эфиры оксикислот с избытком магнийор-ганического соединения реагируют как обыкновенные сложные эфиры. При этой реакции образуются гликоли или фенолоспирты. [5]
Эфиры не имеют гидроксильного атома водорода, поэтому они имеют гораздо более низкие температуры кипения по сравнению со спиртами с тем же числом атомов углерода. [6]
В молекуле более стабильного изомера гидроксильный атом водорода и карбонильный кислород находятся в синперипланарном положении друг к другу. Антиперипланарный изомер на 2 2 ккал / моль ( 9 21 х X Ю3 Дж / моль) менее стабилен. В этих примерах различие в стабильности изомеров очень невелико и не всегда изменяется в одном и том же направлении. [7]
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. [8]
За счет свободных электронных пар кислорода одна молекула спирта взаимодействует с частичным положительным зарядом гидроксильного атома водорода другой молекулы. Образуется особого типа связь - водородная связь. [9]
За счет свободных электронных пар кислорода одна молекула спирта взаимодействует с частичным положительным зарядом гидроксильного атома водорода другой молекулы. Образуется особого типа связь - водородная связь. [10]
При расчете доли у / ух обмена в связях Р - Н кислоты принималось во внимание, что один гидроксильный атом водорода обменивается мгновенно. [11]
Найдено, что в таких реакциях обмена могут принимать участие только алкильные атомы водорода. Гидроксильные атомы водорода спиртов и карбоновых кислот не обмениваются. Не подвержены обмену также атомы водорода ароматического ядра и в а-положении к нему. Показано, что реакция как в случае углеводородов, так и в случае распада перекиси ацетила протекает по молекулярному, а не по радикальному или ионному механизму. Вероятность обмена данного атома водорода частично зависит от его радикальной реакционной способности. [12]
Кроме образования хелатной формы, возможно также возникновение внешней водородной связи. Если гидроксильный атом водорода образует хелаты, то, как показано выше, физические свойства соединения в большей или меньшей степени изменяются. Так, при образовании хелатов повышается летучесть и увеличивается растворимость в неполярных средах. Нитрофенол перегоняется с водяным паром быстрее, чем его пара-изомер. Кроме того, химические свойства гидроксила частично маскируются. [13]
К обширному классу стабильных радикалов с одновалентным кислородом относятся главным образом радикалы фенолов и нафто-лов. Они образуются путем отрыва гидроксильного атома водорода под влиянием различных воздействий: окисления, фотолиза ультрафиолетом, радиационного облучения, химических реакций. Как и в случае радикалов трехвалентного углерода, понятие радикалы одновалентного кислорода условно, так как делокализация неспаренного электрона, как мы увидим дальше, приводит к тому, что резонансная структура с неспаренным электроном на кислороде является одной из многих других структур и вес ее определяется химическим строением радикала и, в свою очередь, определяет его свойства. [14]
С увеличением числа гидро-ксильных групп в молекуле вещества возрастает подвижность гидроксильных атомов водорода. В этих случаях атомы водорода могут замещаться не только свободными ( щелочными) металлами, но и металлами гидроокисей. [15]
Страницы: 1 2