Кристаллизация - бикарбонат - натрий
Cтраница 2
Прямое определение метастабильных давлений в данном случае было возможно потому, что протекавшие в растворе процессы ( гидролиз иона карбамата и кристаллизация бикарбоната натрия) достаточно медленны. Когда реакции идут быстро, такое определение становится невозможным. [16]
Объем кристаллизации бикарбоната натрия в пятикомпонентной системе при постоянных температуре и давлении имеет в качестве внешних границ в трехгранной призме солевого состава поля кристаллизации бикарбоната натрия в четырехкомпонентных системах: Na, NH4 II НСО3, NO3 - HaO: Na, К l HCO3, NO3 - Н2О; Na, К, NH4 II НСОз-Н2О. В настоящем сообщении приводятся результаты изучения растворимости в четверной взаимной системе Na, NH4 II НСО3, NO3 - Н2О при 25 С. [17]
В карбонизационной колонне ( КЛ) содового производства совмещаются основные процессы, протекающие в отделении карбонизации: абсорбция углекислого газа, охлаждение карбо-низуемого раствора и кристаллизация бикарбоната натрия. [18]
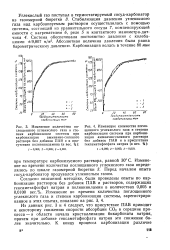
Из данных рис. 3 и 4 следует, что присутствие ПАВ приводит к некоторому снижению скорости абсорбции СО2 в середине процесса - в области начала кристаллизации бикарбоната натрия, причем при добавке гексаметафосфата натрия это снижение более значительно. [20]
С увеличением концентрации СОг в газе возрастает скорость реакции образования NaHCO3 в нижней зоне колонны, а при хорошем охлаждении колонны одновременно увеличивается и скорость кристаллизации бикарбоната натрия. [21]
Влияние температуры на скорость процессов, протекающих в карбонизационной колонне, сложно и неоднозначно; поскольку суммарная скорость процесса карбонизации лимитируется в основном скоростью растворения СС2 в рассоле и скоростью кристаллизации бикарбоната натрия, повышение температуры замедляет карбонизацию и выпадение кристаллов. [22]
 |
Растворимость в системе. [23] |
Образующийся бикарбонат натрия кристаллизуется, и его отделяют от маточного раствора на центрифуге. Процессы карбонизации и кристаллизации бикарбоната натрия протекают при температуре 45 С. [24]
Процесс проводится следующим образом. Раствор с барабанных фильтров, остающийся после кристаллизации бикарбоната натрия и содержащий Na2CO3 и ( МН ЬСОз, нужно нагреть и направить в аппарат для выделения аммиака. Предварительное нагревание можно проводить в теплообменнике, к которому подводятся горячие газы из колонны отгонки аммиака от конденсата и из колонны отгонки аммиака от маточного раствора ( фильтрационного щелока) - регенерация теплоты, косвенный теплообмен, противоток. Дальнейшее нагревание раствора осуществляется в скруббере, где выделяется аммиак. Раствор орошает насадку скруббера и контактирует с горячими газами и паром из дистиллера - прямой нагрев, развитие поверхности соприкосновения фаз, противоток, регенерация теплоты. [25]
Процесс проводится следующим образом. Раствор е барабанных фильтров, остающийся после кристаллизации бикарбоната натрия и содержащий Na2CO3 и ( МЬЦЬСОз, нужно нагреть и направить в аппарат для выделения аммиака. Предварительное нагревание можно проводить в теплообменнике, к которому подводятся горячие газы из колонны отгонки аммиака от конденсата и из колонны отгонки аммиака от маточного раствора ( фильтрационного щелока) - регенерация теплоты, косвенный теплообмен, противоток. Дальнейшее нагревание раствора осуществляется в скруббере, где выделяется аммиак. Раствор орошает насадку скруббера и контактирует с горячими газами и паром из дистиллера - прямой нагрев, развитие поверхности соприкосновения фаз, противоток, регенерация теплоты. [26]
Поля кристаллизации NaHCOg, NH4HC03 и NH4C1 соприкасаются в тройной точке Рг; поля кристаллизации NaCl, NaHC03 и NH4C1 - в тройной точке Ра. Наименьшей растворимостью в этой системе обладает NaHC03, поэтому поле кристаллизации бикарбоната натрия на диаграмме будет наибольшим: оно занимает 2 / 3 площади диаграммы. [27]
Фигуративные точки исходного раствора, содержащего NaCl и NH4HCOa в любых соотношениях, расположены на диагонали, соединяющей вершины квадрата, отвечающие этим солям. При 15 и 30 С ( рис. 80 6) эти точки находятся главным образом в поле кристаллизации бикарбоната натрия. [28]
Фигуративные точки исходного раствора, содержащего NaCl и МНЦНСОз в любых соотношениях, расположены на диагонали, соединяющей вершины квадрата, отвечающие этим солям. При 15 и 30 С ( рис. 98 - 6) эти точки находятся главным образом в поле кристаллизации бикарбоната натрия. [29]
Фигуративные точки исходного раствора, содержащего NaCl и NH4HCO3 в любых соотношениях, расположены на диагонали, соединяющей вершины квадрата, отвечающие этим солям. При 15 и 30 С ( рис. 195, б) эти точки находятся главным образом в поле кристаллизации бикарбоната натрия. [30]
Страницы: 1 2 3