Кристаллизация - данное вещество
Cтраница 1
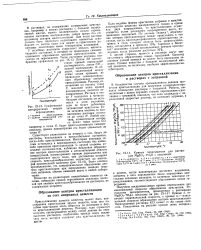 |
Кривые пересыщения для растворов MgSO - 7H2O с затравкой. [1] |
Кристаллизация данного вещества может быть инициирована кристаллами других веществ, если они подобны кристаллам этого вещества по размерам и форме кристаллической решетки. Поэтому, если стремятся получить согласующиеся между собой данные по пересыщению растворов, необходимо прежде всего исключить пыль, которая содержит ряд кристаллических веществ. [2]
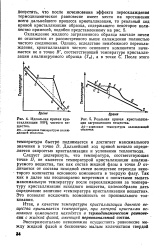 |
Идеальная кривая кристаллизации 100 % чистого вещества.| Реальная кривая кристаллизации загрязненного вещества. RS - изменение температуры охлаждающей. [3] |
Итак, в качестве температуры кристаллизации данного вещества принимается температура, при которой кристаллы основного компонента находятся в термодинамическом равновесии с жидкой фазой, имеющей первоначальный состав. [4]
Выбор способа кристаллизации из растворов определяется формой кривой растворимости и особенностями кристаллизации данного вещества. [6]
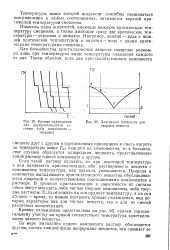 |
Кривые охлаждения [ IMAGE ] Диаграмма плавкости для. [7] |
Кривые охлаждения представлены на рис. 95, причем горизонтальному участку на кривой соответствует температура кристаллизации данного вещества. [8]
В связи с этим поверхностно-активной ( или просто активной) примесью называют вещество, которое заметно влияет на ход кристаллизации данного вещества. [9]
Коэффициент упаковки структуры в целом также оказывается аномально малым ( 0 595), чем, невидимому, объясняется крайняя трудность кристаллизации данного вещества. [10]
При охлаждении вероятность образования устойчивых кристаллических зародышей увеличивается, поскольку уменьшается энергия теплового движения. Температура, при которой образуются такие устойчивые зародыши, является температурой кристаллизации данного вещества. [11]
При быстром охлаждении мономерной или полимерной жидкости ниже Горист ее можно получить в переохлажденном состоянии. Точка пересечения прямых АБ и ДЕ отвечает температуре стеклования, которая всегда ниже температурм кристаллизации данного вещества. Из рис. 58 видно, что при одной и той же температуре свободный объем вещества V Vy - V0 в неравновесном стеклообразном состоянии больше свободного объема кристаллического тела. [12]
Понятие об изоморфизме было установлено Митчерлихом в 1819 - 1820 гг. Под изоморфизмом он понимал сходство кристаллических форм и связанную с ним способность к образованию смешанных кристаллов. Изоморфными телами, по старому классическому представлению, называются такие, которые при одинаковом числе атомов в своих частицах химически сходны, показывают близость свойств и одинаковую или чрезвычайно близкую кристаллическую форму. Важнейшим и наиболее прямым способом суждения об изоморфизме, а также и экспериментальным доказательством его служит свойство двух сходных соединений выделяться из растворов в однородных кристаллах - смешанных кристаллах, содержащих самые разнообразные соотношения между количествами входящих в кристаллы веществ. Кроме того, кристалл изоморфного вещества может служить затравкой для кристаллизации данного вещества из его пересыщенного раствора. [13]
Располагая такой треугольник на горизонтальной плоскости и принимая его за основу, восстановим перпендикулярно плоскости его вертикальную ось. Откладывая по вертикальной оси температуры начала кристаллизации, получают трехгранную призму, каждая из граней которой представляет собой диаграмму состояния соответствующей двойной системы, а верхняя поверхность выражает зависимость температур кристаллизации от состава для тройной системы. В то время как в диаграмме двойной системы зависимость температур кристаллизации данного вещества от состава расплава выражается участком какой-то линии ( кривой кристаллизации), здесь она будет выражаться участком соответствующей кривой поверхности, называемым полем кристаллизации. [14]
Диаграммы плавкости неизоморфных смесей с простой эвтектикой, при кристаллизации которых выделяются чистые твердые компоненты, строятся па основании кривых охлаждения. Если нагреть жидкий цинк или кадмий до высокой температуры и охладить его, то температура будет равномерно понижаться согласно закону охлаждения Ньютона; такой процесс будет происходить до тех пор, пока жидкость не начнет кристаллизоваться. С начала кристаллизации температура устанавливается постоянной до тех пор, пока вся жидкость не затвердеет, после чего охлаждение будет продолжаться по тому же закону Ньютона. Кривые охлаждения ( / и / /) представлены на рис. 103, причем температура, соответствующая горизонтальному участку, будет температурой кристаллизации данного вещества. Линия температурной остановки будет горизонтальной, так как состав жидкой фазы, из которой выпадают кристаллы, не меняется, и поэтому выпадение первых порций кристаллов идет при тех же условиях, что и последних. [15]
Страницы: 1 2
