Координированная лиганда
Cтраница 1
Координированные лиганды могут при - Алкилирование, соединить органические радикалы и нитрование образовать новые соединения. [1]
Координированные лиганды могут участвовать в таких необычных реакциях, которые трудно даже представить в отрыве от комплексов. Мыслимо ли, чтобы гидроксильные группы соединились между собою, находясь в таком положении. [2]
Подобные ряды установлены также для оксалатных производных уранила и для смешанных производных, содержащих различные координированные лиганды. Многочисленные вновь синтезированные соединения заслуживают детального рентгеноструктурного исследования. [3]
В других случаях металл может выполнять роль переносчика электронов и способствовать взаимодействию между двумя координированными лигандами. К этой категории относится окислительное присоединение и обратные ему реакции ( мы их рассмотрим в одной из последующих глав), поскольку они включают переход пары электронов иона металла с несвязывающих МО на связывающие. При этом в известном смысле лиганд восстанавливается и в нем появляется второй донорный фрагмент. Поскольку, как правило, координационное число центрального атома возрастает при окислении, оба фрагмента могут оставаться координированными. [4]
 |
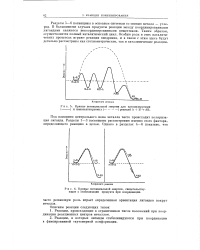
Графический метод нахождения величины Р по соотношению. [5] |
Окислительно-восстановительные фотореакции в случае комплексных соединений могут происходить либо внутримолекулярно - между центральным ионом и координированными лигандами, либо межмолекулярно - между комплексной молекулой и молекулой растворителя или другой частицей, присутствующей в растворе. [6]
Время жизни парамагнитных ядер в первой сфере парамагнитного иона характеризует фактически скорость реакции двойного обмена, протекающей между координированными лигандами ( или отдельными частями их) и лигандами, находящимися в массе раствора. Например, при релаксации протонов в водных растворах величина TB характеризует скорость обмена молекул воды или протонов первой координационной сферы и раствора. Как и для любой химической реакции, скорость этого обмена можно резко изменить двумя путями: изменением температуры или же концентрации обменивающихся частиц в растворе. [7]
В дальнейшем электростатические представления были дополнены квантовым содержанием за счет учета детальной структуры центральных ионов и ее изменений в поле, создаваемом координированными лигандами. Так возникла широко известная в настоящее время теория кристаллического поля, рассматриваемая ниже. [8]
Часть реакций органических координированных лигандов, особенно те, которые не затрагивают донорный атом ( например, ацетилирование ацетилацетопа в его комплексах), аналогичны реакциям свободных лигандов. Так как координированные лиганды отличаются от свободных распределением электронной плотности и конфигурацией, то становятся возможными новые типы реакций. Кроме того, на протекании замещения в лиганде во многих случаях существенно сказывается близость катиона металла. [9]
Реакции органических координированных лигандов, не затрагивающие донорного атома, например сульфирование циклопен-тадиенила в ферроцене или ацетилирование ацетилацетона в его комплексах, протекают как обычные реакции в органической химии. Так как координированные лиганды отличаются от свободных распределением электронной плотности и конфигурацией, то становится возможным протекание реакций, не характерных для свободных лигандов. [10]
 |
Кривые потенциальной энергии, свидетельствующие о стабилизации продукта при координации. [11] |
Разделы 5 - 6 посвящены в основном системам со связью металл - углерод. В большинстве случаев продукты реакции между координированными лигандами являются некоординированными веществами. Таким образом, осуществляется полный каталитический цикл. Особую роль в этих каталитических процессах играют реакции внедрения, и в связи с этим здесь будут детально рассмотрены как стехиометрические, так и каталитические реакции. [12]
Координация лиганда ионом металла может изменить его реакционную способность. В зависимости от действия определенного внешнего реагента координированные лиганды в комплексе могут обладать большей или меньшей реакционной способностью по сравнению с изолированным лиган-дом. Более того, многие реакции, которые катализируются ионами металлов, вероятно, проходят стадию, когда в промежуточном соединении органический субстрат координируется ионом металла. [13]
В предыдущих разделах была подробно рассмотрена структура комплексов и некоторые реакции с участием комплексов, включающие замещение лигандов, изомеризацию и окислительно-восстановительные реакции. Теперь рассмотрим кратко сущность реакций, затрагивающих координированные лиганды. [14]
Комплекс может быть нейтральной частицей, а также положительным или отрицательным ионом в зависимости от зарядов центрального атома и координированных лигандов. Поэтому в комплексных соединениях различают внутреннюю сферу, включающую центральный атом и координированные лиганды, а также внешнюю сферу, образуемую противоионами. В табл. 12 приведены примеры некоторых комплексных соединений и показано, из каких структурных элементов состоят эти соединения. [15]
Страницы: 1 2