Наклон - анодная кривая
Cтраница 1
 |
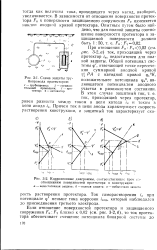
Схематическая поляризационная диаграмма. [1] |
Наклон анодной кривой ( пунктир) показывает смещение потенциала анода в положительном направлении вследствие прохождения тока. Чем круче наклон кривой, тем сильнее поляризуется анод. При больших плотностях тока анодная кривая круто идет вниз. [2]
Это обстоятельство усложняет объяснение величин наклона анодных кривых, полученных в существенно различных условиях. [3]
В зависимости от отношения поверхности протектора Р к поверхности защищаемого сооружения FT изменяется наклон анодной кривой протектора. [5]
Бокрис с сотрудниками [14] установили, что покрытие адсорбированным водородом при потенциале свободной коррозии недостаточно для того, чтобы изменить наклон анодной кривой. [6]
Найденные кинетические зависимости ( 170), ( 171) и ( 172) удовлетворяют известным экспериментальным данным о порядке реакций по ионам ОН, ионам SO и величине наклона анодной кривой Ьа. [7]
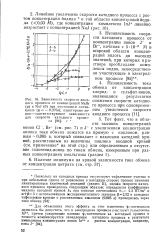 |
Зависимость скорости анодного процесса от концентраций NaBr. [8] |
Тот факт, что в области высоких концентраций ионов С1 -, Вг - ( см. рис. 7) и J - с увеличением концентрации аниона токи обмена ложатся на прямую с наклоном, равным - 0 085 в, который совпадает с наклоном катодной кривой, рассчитанным из величины наклона анодной кривой ( см. примечание на этой стр. [9]
Можно предположить, что при концентрации соляной кислоты в пределах 5 - 10 % происходит совместное растворение всех структурных составляющих стали при компромиссном потенциале. Наблюдающееся изменение угла наклона анодных кривых в 1 % растворе соляной кислоты, возможно, связано с торможением процесса анодного растворения одной какой-либо фазы или совокупности фаз. [10]
Как было отмечено, для амальгамы индия п 3, не зависит от кислотности, и наклон анодных поляризационных кривых не изменяется при переходе к более кислым растворам. Для твердого индия только в слабокислых растворах пг-3, причем наклон анодной кривой близок к наклону анодной кривой для амальгамы. [11]
Как было отмечено, для амальгамы индия п 3, не зависит от кислотности, и наклон анодных поляризационных кривых не изменяется при переходе к более кислым растворам. Для твердого индия только в слабокислых растворах пг-3, причем наклон анодной кривой близок к наклону анодной кривой для амальгамы. [12]
 |
Зависимость стационарной скорости растворения хрома в 1 0 н. растворе H2SO4 от потенциала в области пассивного состояния ( сплошная линия. [13] |
Черными точками отмечены начальные плотности тока, наблюдаемые при переходе от более отрицательного к более положительному значению потенциала. Если соединить эти точки с точками, лежащими на стационарной кривой, то получится семейство пунктирных прямых, имеющих одинаковый наклон, весьма близкий к наклону анодной кривой в активной области. Это указывает на то, что пассивация не изменяет, по крайней мере существенно, поляризуемость хрома. Если бы пассивность была обусловлена образованием фазового окисла, то изменение плотности тока при изменении потенциала должно было бы подчиняться другому закону. Как было показано выше ( § 5), концепция фазового окисла требует изменения скорости процесса при изменении поляризации, следующего закону диффузии в пленке [33, 53], а не уравнению Тафеля. [14]
Общее количество карбидного осадка по отношению-к массе растворенного металла при этом уменьшается. При потенциалах, больших 800 мв, судя по электронным микрофотографиям, начинается растворение частиц кубического карбида М2зС6, что и вызывает, очевидно, изменение угла наклона анодных кривых в этой области потенциалов. [15]
Страницы: 1 2