Напряжение - разложение - электролит
Cтраница 2
Минимальное напряжение на электродах, при котором может протекать стационарный процесс ( i const 0), называется напряжением разложения электролита. Напряжение разложения характеризует общую поляризацию при электролизе и равно сумме ЭДС соответствующего элемента и перенапряжения электродных реакций. Например, теоретически ( при i 0) величина напряжения разложения воды равна равновесной ЭДС элемента, в котором идет электрохимический синтез воды и, как отмечалось в § 1 этой главы, близка к 1 23 В. В этом элементе электроды платиновые. Перенапряжение выделения водорода на платине практически отсутствует, а для выделения кислорода на платине г) 0 45 В. Поэтому напряжение разложения воды при / 0 больше или равно 1 68 В. [16]
Минимальное напряжение на электродах, при котором может протекать стационарный процесс ( t const 0), называется напряжением разложения электролита. Напряжение разложения характеризует общую поляризацию при электролизе и равно сумме ЭДС соответствующего элемента и перенапряжения электродных реакций. Например, теоретически ( при i 0) величина напряжения разложения воды равна равновесной ЭДС элемента, в котором идет электрохимический синтез воды и, как отмечалось в § 1 этой главы, близка к 1 23 В. В этом элементе электроды платиновые. Перенапряжение выделения водорода на платине практически отсутствует, а для выделения кислорода на платине ц 0 45 В. [17]
С возрастанием силы тока перенапряжение сначала резко растет, и при начинающемся образовании пузырьков газа сумма его на обоих электродах ( -) - равновесный потенциал) обуславливает напряжение разложения электролита. При дальнейшем увеличении силы тока перенапряжение продолжает возрастать, но менее резко. Для не слишком больших изменений тока, напр, в отношении 1: 2, можно, в первом приближении, принять, что перенапряжение имеет линейную зависимость от силы тока. [18]
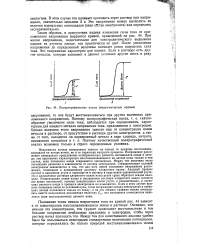 |
Полярографические волны ( вольт-амперные кривые. [19] |
Напряжение начала электролиза зависит не только от природы восстанавливающихся на катоде ионов, но и от характера анодного процесса. Напряжение разложения электролита представляет алгебраическую разность потенциалов анода и катода; оно однозначно характеризует восстанавливающиеся на катоде ионы только в том случае, если потенциал анода сохраняется неизменным. Между тем величина этого потенциала различна в зависимости от состава электролита. Стандартизация условий электролиза заключается в том, что для всех ионов указывают напряжение разложения, отнесенное к насыщенному раствору хлористого калия. Анодный процесс состоит в окислении ртути и переходе ее в раствор в виде ионов одновалентной ртути. Но в насыщенном растворе хлористого калия ионы ртути сразу образуют осадок каломели. Концентрация ионов хлора в насыщенном растворе хлористого калия остается все время постоянной, поэтому концентрация ионов ртути, а следовательно, и потенциал ртутного анода в процессе электролиза не изменяются. Если в этом случае принять потенциал анода за условный нуль, тогда напряжение начала электролиза и потенциал катода отличаются только по знаку, и на осп абсцисс графика можно откладывать вместо напряжения разложения величину Et. [20]
Для электровосстановления или электроокисления различных ионов ( разряда их на электроде) требуется различное напряжение, которое для каждого вида ионов имеет строго определенную величину. Эта величина называется напряжением разложения электролита. Если приложенное напряжение ниже этой величины, окислительно-восстановительный процесс на электроде не протекает и разложение электролита под действием тока ( электролиз) не происходит. Ввиду отсутствия переноса тока ионами электролита сила тока, протекающего через электролит, ничтожно мала. Как только напряжение достигает определенной величины, соответствующей напряжению разложения электролита, начинается электролиз, и сила тока начинает возрастать пропорционально напряжению. [21]
Для практического осуществления электролиза конкретного электролита необходимо определенное минимальное пороговое напряжение, значение которого тем выше, чем труднее разряжаются на электродах катионы и анионы. Это напряжение называется напряжением разложения электролита. [22]
Ряд напряжений имеет большое значение для всех электрохимических методов анализа. В электроанализе ряд напряжений позволяет вычислить напряжение разложения электролита и дает возможность предвидеть условия разделения металлов. [24]
Для разряда различных ионов на электродах требуется напряжение, которое для каждого типа ионов имеет строго определенную величину, называемую напряжением разложения. Как только напряжение достигает определенной величины, соответствующей напряжению разложения электролита, начинается электролиз, и сила тока возрастает пропорционально напряжению. Изменение силы тока в зависимости от напряжения при проведении электролиза с электродом малой поверхности выражают в виде характерных волычампернык Кривых; на основании которых можно с большой степенью точности определить качественный и количественный состав электролитов в анализируемом растворе. [25]
Электродные потенциалы представляют собой индивидуальные характеристики электрохимических реакций и зависят от условий их протекания. Разность потенциалов фа и фк поляризованных электродов называется напряжением разложения электролита V. [26]
Электролизеры с анодом, погруженным в ртутный катод, основаны на том, что электрический контакт между амальгамой натрия и графитовым анодом имеет повышенное сопротивление. Поэтому при повышении плотности тока в контакте между электродами может быть достигнуто напряжение разложения электролита, начнется электролиз и электроды окажутся разомкнутыми тонким слоем электролита, который их смачивает. Выделяющийся при электролизе хлор способствует поддержанию разомкнутого состояния электродов и обмену электролита в месте контакта. [27]
Если разность потенциалов между катодом и анодом каким угодно способом достигнет такого значения, при котором могут разряжаться катионы на катоде и анионы на аноде, то начинается прямоточный электролиз. Разность потенциалов между обоими электродами, которая достаточна для протекания электролиза, называется напряжением разложения электролита. [28]
Разложение веществ под действием электрического тока происходит лишь в определенных условиях, и электролиз может начаться после того, как приложенная извне разность потенциалов превышает величину разности обратимых потенциалов электродов. Максимальная разность потенциалов, которую необходимо приложить, чтобы начался электролиз, называется напряжением разложения электролитов. [29]
Из выражения ( 3.5 следует, что при / np const с ростом 9 истинная плотность тока, а следовательно, и перенапряжение на электродах повышается. В присутствии примесей, адсорбированных на электродах, напряжение на РК достигает своего критического значения ( напряжение разложения электролита) при меньших значениях интегрирующего тока, а предельный ток РК оказывается меньше предельно диффузионного. [30]
Страницы: 1 2 3
