Sd-элемент
Cтраница 1
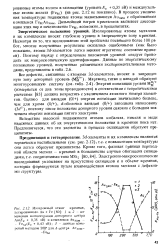
Sd-элементы и их комплексы являются термически нестабильными ( см. рис. 2.12), т.е. с повышением температуры они легко образуют преципитаты. Электронно-микроскопические исследования указывают на присутствие силицидов и в объеме кремния, которые формируются путем взаимодействия атомов металла с дефектами структуры. [2]
После первого Sd-элемента - лантана, находящегося в 3 - й группе и открывающего третий переходный ряд, следуют 14 4 / - элементов - лантаноидов, которые мы рассмотрим отдельно в гл. Таким образом, следующий за лантаном элемент 4 - й группы - гафний - отстоит от него на 15 атомных номеров. Это приводит к дополнительному стягиванию атомного остова у последующих элементов шестого периода. В результате радиусы атомов элементов третьего переходного ряда от гафния до ртути оказываются почти такими же, как у их аналогов по группам из второго переходного ряда ( от циркония до кадмия), - происходит так называемое лантаноидное сжатие. [3]
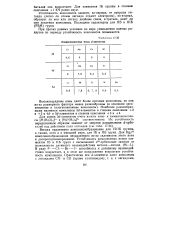 |
Координационные числа ( / - элементов. [4] |
Для химии Sd-элементов очень важны акво - и амминокомплек-сы [ М ( Н2О) 6 ] 2 и М ( МН3) б ] 2 соответственно. [5]
Платина, подобно другим Sd-элементам, об-р 1зует гексафторид PtFe. С) темно-красного цвета, получают его сжиганием платины во фторе. Особо неустойчив PtFe, он относится к числу наиболее сильных окислителей ( сродство к электрону 7 эВ), является самым сильным из всех известных фторирующих агентов. Так, он легко фторирует BrF3 до BrF5, бурно реагирует с металлическим ураном, образуя UF6, разлагает воду с выделением кислорода, реагирует со стеклом. [6]
В ряду соединений Sd-элементов со степенью окисления - f II очень неустойчивы соединения Ti, что объясняет их сильные восстановительные свойства. У соединений последующих членов ряда при переходе слева направо устойчивость увеличивается и, соответственно, уменьшается восстановительная способность. [7]
Задачей настоящего исследования является выяснение закономерностей распределения примесей Sd-элементов в области их малых - концентраций, выяснение механизма соосаждения с целью обоснования предельной очистки в различных вариантах перехода кристаллизанта из жидкого в твердое состояние. [8]
Необходимо отметить, что ионы Ы - и Sd-элементов характеризуются большей тенденцией к спариванию спинов, чем ионы Зс. Это является следствием увеличения энергии расщепления Л при переходе по подгруппе периодической системы сверху вниз при одних и тех же лигандах. [9]
Сходство в химических свойствах оксидов Зр - и Sd-элементов еще больше: аналогичны формулы оксидов, соответствующих им гидроксидов, кислот и солей; с ростом порядковых номеров элементов кислотные и окислительные свойства быстро нарастают, а склонность к образованию полимеров уменьшается. Эти изменения происходят так, что аналогичные пары соединений Зр - и Sd-элементов имеют совпадающие или близкие качественные характеристики. [10]
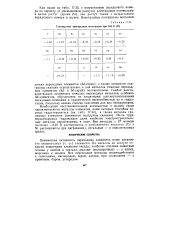 |
Стандаргные электродные потенциалы при 298 К ( В. [11] |
Слабая восстановительная активность тяжелых переходных металлов, особенно Sd-элементов, обусловлена их защитными плотноупакованными оксидными пленками и практической неспособностью их к гидратации, поскольку низкие степени окисления для них нехарактерны. Из-за труднорастворимых гидроксидов даже наиболее электроотрицательные металлы нерастворимы в воде. Все металлы с Е меньше значения - 0 25 В растворяются в разбавленных кислотах ( Со и Ni растворяются при нагревании), остальные - в окислительных средах. [12]
Фосфор, как и сера, является предвестником Sd-элементов; находясь в V группе, фосфор и его гомологи ближе, чем сера, по свойствам к переходу в металлическое состояние, которое уже намечается у мышьяка и явно представлено у сурьмы и висмута, тогда как в VI группе только полоний мог быть отнесен к металлам. [13]
Итак, за двумя бе-элементами в шестом периоде следует один Sd-элемент - лантан La, а за лантаном La располагается четырнадцать 4 / - элементов. [14]
Чтобы проверить это мнение, мы предприняли исследование растворов перхлоратов Sd-элементов, где образование ацидокомплексов практически не происходит. [15]
Страницы: 1 2 3 4