Ss-электрон
Cтраница 3
Заполненная 4d10 - o6ofl04Ka экранирует бе-электроны серебра и кадмия значительно слабее, чем внешняя 4 24ре - оболочка экранирует Ss-электроны рубидия и стронция. [31]
У двухвалентных металлов имеется два внешних электрона в s - состоянии на атом ( например, у магния два Ss-электрона), поэтому зона s - уровней будет целиком заполнена. В этом случае Ss-зона также перекрывается с более высокими зонами, однако сначала мы рассмотрим, что получилось бы, если бы зоны не перекрывались. Если бы Ss-зона была отделена от следующей более высокой зоны запрещенной областью энергий, то невозможно было бы ускорить какой-либо из электронов этой зоны приложением электрического поля обычной величины, так как в этой зоне нет свободных уровней с немного большей энергией, на которые мог бы перейти электрон. Таким образом, хотя в таком твердом теле имелось бы много движущихся электронов, ни один из них не мог бы участвовать в электропроводности, поскольку только очень сильное электрическое поле может вызвать переход электрона в следующую, более высокую зону, если зазор между зонами не очень мал. При температурах, не слишком высоких ( до 2000 К), только очень небольшое количество электронов переходит в более высокую зону. Итак, если бы зоны не перекрывались, двухвалентные элементы в твердом состоянии представляли бы собой диэлектрические кристаллы, у которых валентные электроны целиком заполняют одну из зон. В действительности же у всех двухвалентных элементов в твердом состоянии зоны перекрываются, поэтому часть валентных электронов может ускоряться электрическим полем, вследствие чего двухвалентные элементы в твердом состоянии являются металлами. У некоторых четырехвалентных элементов в твердом состоянии заполненные зоны не перекрываются, поэтому, например, углерод в виде алмаза и не содержащие примесей кремний и германий имеют очень малую электропроводность. [32]
 |
Схематическое изображение ковалентной связи между двумя атомами водорода в. молекуле водо - рода. [33] |
Таким образом, литий и натрий могут достигнуть электронной конфигурации благородных газов гелия и неона, отдавая свои 25 - и Ss-электроны соответственно другим элементам, например галогенам. [34]
Это объясняется тем, что завершенная 4с2 - подоболочка появляется уже у палладия, так как энергии связи 4d - и Ss-электронов в этой области почти одинаковы. [35]
Можно видеть, что величина hp изменяется таким же образом, как и изомерный сдвиг, что указывает на линейную зависимость между плотностью Ss-электронов, мерой которой является величина изомерного сдвига, и числом 5р - дырок. Этот важный результат был использован для калибровки значений изомерного сдвига в единицах относительной плотности Ss-электронов. [36]
РЛ и Dn - заселенности 5р - и 5 я-состоя-ний; ро - относительное различие полной плотности на ядре электронов остова нейтрального атома олова при удалении одного Ss-электрона. [37]
Если начать рассмотрение с сульфониевых илидов, то один из очевидных способов увеличения положительного заряда на атоме серы состоит в том, чтобы каким-то образом связать пару остающихся неподеленными Ss-электронов. Формально достичь этого можно окислением сульфониевой соли. [38]
Анализ рис. 37 показывает степень условности разделения электронных уровней на неподеленные пары и уровни а - или я-связи: практически в каждом уровне ( за исключением нижних уровней, соответствующих С1 Ss-электронам) представлены орбитали С 2р, С1 Зр и F 2p, однако четко проявляются основные максимумы распределения этих орбиталей. Это оправдывает упрощенное описание уровней с выделением какой-то одной его основной стороны и сравнение энергий молекулярных уровней с атомными ( гл. [39]
Сначала уравнение Шредингера для 2р - электропа записывается через кинетическую энергию, ядерное притяжение и электрон-электронные отталкивания, но послетдшй член в этом уравнении обусловлен электронами, распределенными что предполагаемым орбиталям, за исключением Ss-электрона, который распретелен на улучшенной орбнтали, найденной на первом этапе. Численное решение такого уравнения приводит к улучшенной 2р - орбиталн. Этот процесс повторяется чля 2s - и Ь - орбиталей, каждый раз с использованием улучшенных ор-биталсй для расчета выражения тля потенциала отталкивания. В конце процедуры в распоряжении оказывается набор орбнталей, отличающийся от набора, который предполагался вначале. Затем весь процесс повторяется с использованием улучшенных орбита-лей, и получается второй набор улучшенных орбиталей. Эти никлы следуют один за другим, пока не будут получены орбитали, которые незначительно отличаются от орбиталей предпоследнего цикла. Эти орбитали являются самосогласованными и рассматриваются как решение задачи. [40]
В этом случае переход от ковалентной конфигурации ( 5s) a ( 5p) 2 к ионной ( 5s) 2 соответствует увеличению плотности 5з - электронов; это происходит вследствие того, что 5р - электроны в ковалентных соединениях экранируют ядро от Ss-электронов. [41]
Однако из табл. 4 видно, что Pd занимает особое место среди металлов VIII группы, так как только у него полностью отсутствуют электроны на внешнем электронном слое О. Отсутствие Ss-электронов в атоме Pd может иметь следствием высокую способность Pd растворять водород [11], что подтверждается многочисленными экспериментальными данными. [42]
Достаточно сопоставить ход орбитальных радиусов 3d - и 4 -электронов, чтобы сделать новое качественное заключение. Поэтому эндо-эффект замены Ss-электрона на 4d будет облегчен, а энергетический перепад от Tcd4sa к Tcd5s сократится. [43]
При сближении атомов Зз-электроны возбуждаются, дискретный уровень расширяется в энергетическую полосу, сохраняющую признаки Зз-состояния не только по энергиям, но и по симметрии. Иными словами, возбуждение Ss-электронов происходит путем увеличения: радиуса и толщины шарового слоя, отвечающего Зэ-орбитали. В результате расширения внешних s - орбиталей они перекрываются пс кратчайшим расстояниям между ядрами. Перекрытие или сгущение s - состояний в области касания атомов отвечает металлической связи вследствие стягивания положительно заряженных ядер концентрирующимися между ними электронами. Максимальная плотность s - электронов возникает в областях перекрытия между ядрами, куда притяжение к ядрам стягивает электроны из периферийных областей s - орбиталей. Минимальная плотность s - состояний отвечает областям, наиболее удаленным от ядер в решетке, а именно центрам окта-эдрических и тетраэдрических междоузлий. Электроны, находящиеся здесь, наиболее свободны и осуществляют металлическую-проводимость. Этим состояниям электронов отвечает верх s - полосы. Электроны, находящиеся в области перекрытиями участвующие в образовании металлических связей, наиболее сильно взаимодействуют с ядрами, имеют малую подвижность и им соответствует дно s - полосы. Поскольку минимуму свободной энергии системы отвечает максимальное число связей на один атом, то оптимальному взаимодействию сферически симметричных s - орбиталей отвечает плотнейшая упаковка с 12 соседями у каждого атома. [44]
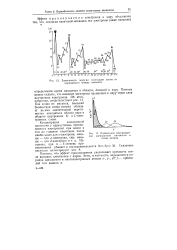 |
Зависимость энергии ионизации атома от порядкового номера элемента.| Радиальное распределение электронной плотности в атоме натрия. [45] |
Страницы: 1 2 3 4 5