Автопротолиз - вода
Cтраница 2
ОН ] - молярные концентрации; Л авТо константа автопротолиза воды, равная 1 00 - 10 14 молъ / л при 25 С. [16]
Совершенно очевидно, что концентрация ионов водорода в результате автопротолиза воды очень незначительна. Фактически автопротолиз воды не играет в этом случае существенной роли до тех пор, пока не добавят больше чем 49 999 мл из требуемых 50 мл титранта, поэтому пренебрегают влиянием автопротолиза воды. [17]
 |
Изменение рН в процессе титрования 50 00 мл 0 1000 F раствора хлористоводородной кислоты 0 1000 F раствором гидроксида натрия. [18] |
Если объем прибавленного раствора гидроксида натрия равен или больше 50 001 мл, автопротолиз воды не играет заметной роли, поэтому вторым членом правой части каждого из этих уравнений можно пренебречь. [19]
В очень разбавленных растворах слабых кислот ( сЮ - бМ) необходимо учитывать еще и автопротолиз воды, концентрация ионов гидрония которой становится при этом соизмеримой с концентрацией ионов слабой кислоты. Вычисления тогда становятся более сложными, и мы не будем на них здесь останавливаться. [20]
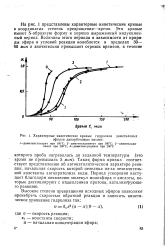 |
Характерные кинетические кривые гидролиза диметиловых эфиров дикарбоновых кислот. [21] |
Такая форма кривых соответствует представлению об автокаталитическом характере реакции, начальная скорость которой невелика из-за незначительной константы автопротолиза воды. Период ускорения наступает благодаря появлению молекул моноэфира и кислоты, которые диссоциируют с отщеплением протона, катализирующего реакцию. [22]
Отсюда вытекает, что концентрация бензойной кислоты не равна концентрации гидроксид-ионов, как мы предварительно приняли, когда пренебрегали автопротолизом воды. [23]
 |
Зависимость рН водных растворов слабых протолитов от Р / ( А протолитической пары и от показателя концентрации растворенного протолита. [24] |
В области показанной пунктиром, вокруг линии с рН 7 формулы (4.23) и (4.24) не дают правильных результатов по той причине, что в этих условиях необходимо учитывать автопротолиз воды. [25]
Однако численно константа диссоциации иона аммония - ( / С0) более чем в 50000 раз больше, чем ионное произведение воды ( Kw), поэтому вклад автопротолиза воды в создании концентрации ионов водорода не является существенным. [26]
Совершенно очевидно, что концентрация ионов водорода в результате автопротолиза воды очень незначительна. Фактически автопротолиз воды не играет в этом случае существенной роли до тех пор, пока не добавят больше чем 49 999 мл из требуемых 50 мл титранта, поэтому пренебрегают влиянием автопротолиза воды. [27]
Проверим правильность нашего допущения. Является ли автопротолиз воды незначительным источником гидроксид-ионов. [28]
Определение кислот и оснований по Бренстеду позволяет систематизировать множество химических реакций. Реакция нейтрализация по Бренстеду обратив автопротолизу воды, а поскольку последний протекает в малой степени, то реакция нейтрализации оказывается практически необратимо проходящей до конца. [29]
 |
Изменение рН в процессе титрования 25 00 мл 0 1000 F раствора уксусной кислоты 0 1000 F раствором гидроксида натрия. [30] |
Страницы: 1 2 3