Иодометрический анализ
Cтраница 1
Метод иодометрического анализа предложен в 1840 г. Дюпаскье и в 1853 г. Бунзеном. Этот метод был в 1853 г. значительно улучшен Шварцем, который ввел для титрования иода тиосульфат натрия Na2S2O3, тогда как Бунзен титровал иод сернистой кислотой. Конец титрования в иодометрии может быть установлен по исчезновению интенсивной окраски, принадлежащей самому иоду. В концентрированных растворах иода эта окраска коричневая, в разбавленных - желтая. [1]
Метод иодометрического анализа предложен в 1840 г. Дюпаскье и в 1853 г. Бунзеном. В 1853 г. Шварц значительно улучшил метод. Он ввел для титрования иода тиосульфат натрия, а Бунзен титровал иод раствором сернистой кислоты. Окончание титрования в иодомет-рии устанавливают по исчезновению интенсивной окраски, принадлежащей иоду. В концентрированных растворах иода эта окраска коричневая, в разбавленных - желтая. При титровании бесцветных растворов конечную точку титрования устанавливают непосредственно по окраске титрующего раствора, так же как при перман-ганатометрии. Более чувствительным индикатором служит крахмал, который образует яркое синее соединение с иодом. Не только амилоза и амилопектин, входящие в состав крахмала, но и многие другие химические соединения дают аналогичную реакцию с иодом. Образуются так называемые соединения включения, занимающие промежуточное положение между твердыми растворами внедрения и химическими соединениями. Соединения включения получаются, когда молекулы одного индивидуального химического вещества входят в свободные полости внутрь молекул ( или кристаллических решеток) другого индивидуального химического вещества. [2]
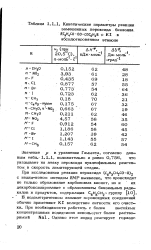 |
Кинетические параметры реакции замещенных пероксида бенэоила. КС6Н4СО - 00 - СОСбН4Н с К1 в. [3] |
В: иодометрическом анализе - пироксидных соединений обычно применяют К1 вследствие легкости его очистки. [4]
В табл. 4.2 представлены результаты иодометрического анализа некоторых имеющихся в продаже спиртов, чистых для анализа. [6]
Большой величиной коэффициента распределения хлороформа объясняется его использование в качестве индикатора при иодометрическом анализе. Знание коэффициента распределения важно и для промышленности при выборе растворителя, наиболее подходящего для экстракции данного растворенного вещества. [7]
Медь ( II) является окислителем, и для ее анализа используют обычный прием иодометрического анализа окислителей - титрование методом замещения. К анализируемому раствору соли меди ( II) добавляют заведомый избыток раствора иодида калия. Медь ( II) окисляет иодид с образованием иода. Иод выделяется в количестве, эквивалентном меди ( II), и его оттитровывают раствором тиосульфата. [8]
Если вначале концентрация образовавшейся пербен-зойной кислоты мала, но скорость ее распада также мала, то иодометрический анализ может показать отсутствие расхода перекиси. [9]
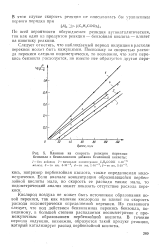 |
Влияние на скорость реакции перекиси бензоила с бензиламином добавок бензойной кислоты. [10] |
Если вначале концентрация образовавшейся пербензойной кислоты мала, но скорость ее распада также мала, то иодометрический анализ может показать отсутствие расхода перекиси. [11]
Наличие высоких концентраций взвешенных твердых частиц и биологическая активность хлопьев активного ила могут привести к быстрому потреблению кислорода, поэтому необходимо подавить активность микроорганизмов во время отбора пробы и удалить взвешенные твердые частицы из раствора осаждением: до проведения иодометрического анализа. Для этого применяют общепринятую методику, заключающуюся в использовании медного сульфат-сульфамин-кислотного ингибитора, подавляющего биологическую активность микроорганизмов и вызывающего флокуляцию взвешенных частиц. Рекомендуемая методика отбора проб предусматривает прежде всего добавление 10 мл ингибитора в бутылку емкостью 1 л с широким горлом. Для отбора пробы из аэротенка используют специальный пробоотборник, сконструированный так, что бутылка заполняется из трубки, расположенной у дна резервуара, при этом через бутылку переливается избыток воды, составляющий около 25 % емкости бутылки. Затем бутылку вынимают из пробоотборника, закрывают пробкой и оставляют в покое для осаждения частиц ила до тех пор, пока не образуется чистый надиловый слой, который затем сифонируют в склянку для определения ВПК. Только после этого производят анализ на содержание растворенного кислорода описанным выше азид-иодометрическим способом. [12]
Здесь учащиеся снова встречаются с иодометрическим методом анализа и приготовлением рабочих растворов иода и тиосульфата, знакомыми им из практикума по объемному анализу. Теперь они должны освоить приемы иодометрического анализа ароматических оксисоединений. Нужно объяснить учащимся, что, так как эти вещества плохо растворяются в воде, их переводят в раствор, добавляя щелочь или соду. К полученному раствору добавляют раствор иода и затем титруют тиосульфатом избыток иода, не вошедший в реакцию. Особое внимание нужно обратить на особенности анализа различных оксисоединений. Гидрохинон количественно реагирует с иодом в уксуснокислой среде при охлаждении льдом. Избыток иода титруют сразу. При расчете следует помнить, что грамм-эквивалент иода в этих реакциях различен: 1 моль иода реагирует с 1 моль бета-нафтола или с 1 / 2 моль резорцина. [13]
Эта реакция, лежащая в основе иодометрического анализа, дает чистый тетратионат с хорошим выходом. Выпавший тетратионат калия тщательно промывался спиртом до удаления KI и затем очищался, как описано выше. [14]
Иногда требуется определять пероксиды в средах, в которых нельзя проводить восстановление с выделением иода из иодида калия. Обычными органическими растворителями, в которых можно проводить иодометрический анализ, являются этанол и изо-пропанол. Для анализа пероксидов ненасыщенных органических соединений, например в полимерах, иодометрические методы использовать нельзя, так как основная реакция может осложняться процессами окисления и замещения. [15]
Страницы: 1 2
