Электронопритягивающий заместитель
Cтраница 1
Электронопритягивающие заместители ( хлор и др.) действуют в противоположном направлении. Отсюда понятно, почему кетоны менее реакционноспособны, чем альдегиды, и почему муравьиный альдегид обладает наибольшей реакционной способностью среди всех альдегидов. [1]
Электронопритягивающие заместители R действуют в противоположном направлении. [2]
Хлор и нитрогруппа являются электронопритягивающими заместителями и вызывают индукционное смещение электронов, благоприятное для отщепления водорода гидроксильной группы в виде протона. [3]
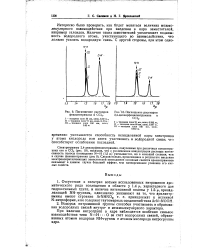 |
Поглощение растворов фенилнитрамина в СС14.| Поглощение растворов. [4] |
Следовательно, происшедшее в результате введения электронопритягивающих заместителей уменьшение основных свойств арилнитраминов оказывает в данном случае больший эффект, чем одновременное усиление его кислых свойств. [5]
Фосфонат-карбгнионы легко могут образоваться, если атом углерода, связанный с фосфором, содержит электронопритягивающие заместители. [6]
Из данных табл. 5 видно, что электроноотталкивающие заместители, например алкильные группы ( - f - / - эффект), уменьшают кислотность, а электронопритягивающие заместители ( - /), например группы, включенные в таблицу, увеличивают кислотность бензойной кислоты в том случае, когда они находятся в мета-иолотения по отношению к карбоксильной группе. Согласно сказанному выше, это явление объясняется индукционным эффектом, вызываемым этими заместителями. [7]
Устойчивость комплексов такого типа тем больше, чем больше электроноотталкивающих групп ( например, групп СН3 и других заместителей первого рода), увеличивающих электронную плотность в ядре, содержит бензоидная компонента и чем большим числом электронопритягивающих заместителей обладает хиноидная компонента. [8]
Амины диазотируются тем легче, чем выше их основность. Когда основность амина сильно понижена вследствие наличия электронопритягивающего заместителя в ядре, как, например, в случае нитроанилина, то диазотирование можно осуществить только в растворе концентрированной серной кислоты или в других сильных кислотах. [9]
Амины диазотируются тем легче, чем выше их основность. Когда основность амина сильно понижена вследствие наличия электронопритягивающего заместителя в ядре, как, например, в случае нитроанилина, то диазотирование можно осуществить только в растворе концентрированной серной кислоты или в других сильных кислотах. [10]
Концентрация минеральной кислоты определяется основностью амина: для аминов типа анилина достаточно 2 5 - 3 моля кислоты на 1 моль амина. Если основность амина сильно понижена вследствие наличия электронопритягивающего заместителя в ядре ( наприм. [11]
Концентрация минеральной кислоты определяется основностью амина: для аминов типа анилина достаточно 2 5 - 3 моля кислоты на 1 моль амина. Если основность амина сильно понижена вследствие наличия электронопритягивающего заместителя в ядре ( наприм ( р, у нитроанилина), то диазотиро-вание можно осуществлять только в растворах концентрированной серной кислоты. [12]
Энергетика отрыва водорода галогеном в таких реакциях, как ( 30) или ( 32), не объясняется только учетом содержания энергии возможного радикала - СК3, поскольку найдено, чго и при хлорировании, и при бромировании действуют полярные эффекты, хотя и в менее заметной степени, чем при гетероли-тическом галогенировании. Точно так же, как перекисные радикалы атакуют замещенные бензальдегиды менее легко, если присутствуют электронопритягивающие заместители [ реакция ( 4), стр. [13]
Во-вторых, препятствием для реакции может явиться наличие сильных электронопритягивающих групп. Оксиальдегиды, однако, часто можно получить, используя близкую к реакции Соммле реакцию Дуффа ( стр. Если у замещенных фенолов имеются электронопритягивающие заместители, то они могут компенсировать влияние гидроксильных групп; так, например, по методу Соммле могут быть получены нитрооксибензальдегиды. Аналогично, при наличии двух атомов хлора в 3 5-дихлор - 2-окоибензил-хлориде 3 5-дихлор - 2-оксибензальдегид образуется с хорошим выходом; дезактивирующий эффект одного атома хлора недостаточен для компенсации влияния гидроксильной группы. Хлор-4 - оксибензальдегид получается из З - хлор-4 - оксибензилхлорида с низким выходом и сильно загрязненным. Нежелательное влияние тидроксильной группы можно устранить алкилирование или ацилированием ее [17-19]; таким образом реакция Соммле становится осуществимой. Ацильная группа во время реакции отщепляется. [14]
Ненасыщенность оказывает наибольшее влияние в случае формально нейтральных заместителей с неподеленными электронами, способными к сопряжению с ароматическим ядром; такие заместители являются орщо-дара-ориентирующими независимо от направления их индуктивного эффекта. Это влияние соответствующим образом расположенных неподеленных электронных пар недостаточно для того, чтобы обратить лшпа-ориентацию таких заместителей с формальным положительным зарядом, как, например, сульфоний - и иодоний-ионы. Однако это влияние превосходит леота-ориентацию, которую можно ожидать от нейтральных групп, например от таких электронопритягивающих заместителей, как галогены и алкоксильные группы. Такой эффект приписывается возникновению отрицательных зарядов в орто - и иора-положениях вследствие сопряженного смещения неподеленных электронных пар заместителя по - - К-механизму ( гл. [15]
Страницы: 1