Фенильный заместитель
Cтраница 1
Фенильный заместитель также относится к типу ( 3), однако для него нет такого резкого различия между электроотрицательным индуктивным эффектом и электроположительным эффектом сопряжения; тем не менее электроотрицательность фенила еще слишком мала ( или сопряжение слишком велико), чтобы могла наблюдаться аномалия Голлемана. Таким образом, в этом случае распределение реакционной способности по кольцу качественно соответствует случаю метоксигруппы, однако различие между разными положениями выражено менее резко. Хотя экспериментальных данных недостаточно, не может быть сомнений, что в рассматриваемых реакциях влияние хлора соответствует этому общему положению. На схемах, приведенных ниже, над стрелками указаны отщепляющиеся группы, а под стрелками - ацидолизирующий агент: символ а обозначает систему НСЮ4, Н 0, СН3ОН, 51 С, символ б - НСЮ4, Н20Г С2Н5ОН, 25 С, и символ в - H2S04, H20, СН3СООН, 50 С. [1]
Фенильные заместители ведут себя, как заместители со слабо выражен ными электроноакцепторными свойствами. Карбоксильные, карбомет-оксильные, ацетильные и галогенные заместители оттягивают электроны и значительно замедляют дейтерирование. Наоборот, метоксильные группы немного ускоряют, но все же слабее, чем алкильные. Итак, можно сделать вывод о том, что ферроцен поддается гораздо легче действию электроноак-цепторных заместителей, чемэлектронодонорных. Уменьшение реакционной способности атомов водорода 5-членных циклов в ходе электрофильного замещения под влиянием акцепторных заместителей наблюдается не только в случае дейтерообмена, но также и в других реакциях электрофильного замещения; ацетилирование и сульфирование производных ферроцена, несущих; электроноакцепторные заместители, такие, как ацетильные группы [17,18], карбометоксильные [17, 19, 20], бром [21], фенил [22], протекает труднее, чем для ферроцена; эти группы вступают главным образом в свободный цикл. [2]
Хотя фенильные заместители создают меньшие стерические препятствия, чем грег-бутильные [87], устойчивость трифенилфенокси-ла не уступает устойчивости три-грег-бутилфеноксила, а в некоторых случаях, например по отношению к реакции с кислородом, даже превосходит ее. [3]
Введение фенильного заместителя ( Макс 255 ммк) в ядро вызывает гипсохромный сдвиг, различный для каждого изомера. [4]
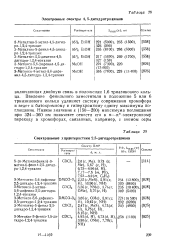 |
Спектральные характеристики 2 5-дигидротриазинов. [5] |
Введение фенильного заместителя в положение 5 или 6 триазинового кольца удлиняет систему сопряжения хромофора и ведет к батохромному и гиперхромному сдвигу максимума поглощения. [6]
Отрыв фенильного заместителя становится возможным также только на этой стадии. Образующийся при этом бензазатропилие-вый ион с массой 142 при дальнейшем распаде дает ионы с массой 115 и 116 по механизму, описанному для метилиндолов. [7]
Введение второго фенильного заместителя к атому с неподеленными электронными парами не вызывает дальнейшего смещения полосы, а приводит только к увеличению интенсивности. По-видимому, это связано с тем, что неподеленная пара в рассматриваемых случаях гибриди - - зована и не имеет чистого р-характера, в результате чего бензоль-ные кольца лежат в разных плоскостях и не взаимодействуют между собой, ар - я-сопряжение каждого из них с центральным атомом осуществляется за счет соответствующей р-составляющей гибридизованной / г-орбитали. [8]
В случае фенильного заместителя в положении 4 триазино-вого кольца замещение метилмеркаптогруппы на гидразин протекает с перегруппировкой и получением 4-аминотриазинов. Так, при кипячении в спирте 3-метилмеркапто - 4 6-диарил - 1 2 4-триазин - 5 ( 4Н) - онов с 80 % гидразингидратом, наряду с замещением метилмеркаптогруппы на остаток гидразина происходит внутримолекулярная перегруппировка с образованием соответствующего 4-аминотриазина. На первом этапе процесса происходит замещение метилмеркаптогруппы в положении 3 кольца на гидразин. Далее идет нуклсофильная атака второй молекулы гидразина по электроиодефицитному положению кольца, ведущая к присоединению гидразина по карбонильной группе. Устойчивость продукта замещения зависит от характера заместителя в положении 4 кольца. Если в положении 4 кольца - алкил, то цикл устойчив и продуктом реакции является 3-гид-разино - 4 - К1 - 6 - К2 - 1 2 4-триазин - 5 ( 4Н) - он, образующийся в результате отщепления гидразина от углерода в положении 5 кольца. Интермедиат циклизуется за счет присоединения группы - NH - карбгидра-зонового остатка по карбонильной группе гидразида. Последующее отщепление гидразина приводит к конечному продукту реакции - 3-фениламино - 4-амино - 6 - К-124 - триазин-5 ( 4Н) - ону. Принципиально возможно протекание циклизации интермедиа-та по другому пути: при взаимодействии - NH-группы гидра-зидного остатка с атомом углерода ( бывший Qsj) в карбгид-разоновом остатке. При этом должен образоваться 3-гидрази-но - 4-амино - 6 - К-124 - триазин-5 ( 4Н) - он, который в результате реакции не был выделен. [9]
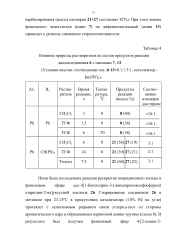 |
Влияние природы растворителя на состав продуктов реакции. [10] |
При этом замена фенильного заместителя ( имин 7) на дифенилметильный ( имин 13) приводит к резкому снижению стереоселективности. [11]
При введении второго фенильного заместителя в ядро пиразола, как и в случае монофенильных производных, отрывается HCN у W-фенилпроизводных ( 1 3-дифенилпиразол, 1 5-дифенилпиразол и 1 4-дифенилпиразол) и два соседних атома азота у С-фенилпроиз-водного ( 3 5-дифенилпиразол), что подтверждается наличием в масс-спектрах соответствующих метастабильных пиков. [12]
Большое ускоряющее действие оказывают фенильные заместители, способные делокализовать отрицательный заряд, а также увеличивающие стабильность образующегося олефина за счет эффекта сопряжения. [13]
Для описания взаимного расположения фенильных заместителей в работах [230-232] использовано представление об идеальной модели, в которой неподеленная пара электронов - As расположена под равными углами ко всем связям, а нормали к Ph-кольцам лежат в плоскостях, определяемых неподеленной парой и связями As-С. [14]
Энергия взаимодействия пиразола и фенильного заместителя оказывает влияние на вероятность разрыва связи между этими ароматическими системами, а поэто му интенсивности пиков иона с массой 77 составляют 11 7 и 6 1 % от полного ионного тока соответственно для 1-фенилпиразола и 3 ( 5) - фенилпиразола. [15]
Страницы: 1 2 3 4