Заряд - коллоид
Cтраница 2
Приведенные скорости являются, однако, несомненно максимальным значениями. Из того, что заряд коллоидов можно уменьшать или даже изменять его знак, следует, что должны встречаться и меньшие скорости. Сама электропроводность электролита в большей или меньшей мере меняется от прибавления коллоида. [16]
Коагуляция применяется для освобождения воды от органических и минеральных коллоидно-дисперсных пе-ществ путем их укрупнения. Коагуляция достигается присадкой к воде электролитов, нейтрализующих заряд коллоидов, в результате чего коллоиды приобретают способность слипаться и выпадать под действием силы тяжести. [17]
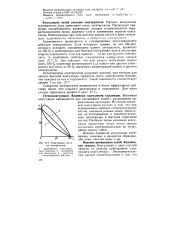 |
Коагуляция смесями электролитов. [18] |
Механизм взаимной коагуляции состоит в том, что при перекрывании двойных слоев коллоидных частиц, имеющих разные знаки, происходит не отталкивание, а электростатическое притяжение и быстрая агрегация частиц. Наиболее полно взаимная коагуляция происходит тогда, когда заряды коллоидов, противоположные по знаку, равны между собой. [19]
Нг по направлению к рН и тем самым повлечь за собой чреватый физиологическими последствиями эффект-нейтрализацию или даже перезарядку био-коллоидов. При ненормальном повышении лабильности ткани эта разность, а следовательно, и заряд тканевых коллоидов должны принимать еще меньшую, чем в норме, величину. [20]
 |
Схема заряда на поверхности коллоидной частицы. А-двойной электрический слой. В - диффузный слой ( ионная атмосфера. [21] |
Рассмотрев условия возникновения электрического заряда, необходимо более детально разобрать вопрос об электрических свойствах коллоидных систем. Мы видели, что в результате диссоциации стабилизатора поверхность коллоидной частицы заряжается положительно или отрицательно и что при этом ион, противоположный знаку заряда коллоида, уходит в дисперсионную среду. Однако, благодаря силам электростатического притяжения, он должен удаляться на расстояние, не превышающее диаметр молекулы. [22]
Прибавление электролита к раствору коллоида вызывает нейтрализацию зарядов частиц коллоида зарядами ионов, а это изменяет поверхностное натяжение частиц, вызывая осаждение коллоида. Как можно показать в ряде опытов, коллоидные растворы осаждаются действительно теми ионами, которые имеют знак, противоположный знаку заряда частиц коллоида, и могут нейтрализовать заряды коллоида, и, наоборот, ионы того же знака действуют на коллоид, защищая его от свертывания. Процессы осаждения, вызываемые а и ( 3-лучами радиоактивных тел в растворах коллоидов, должны быть также объяснены нейтрализацией зарядов коллоидных частиц, влекущих за собой коагуляцию. [23]
Для удаления грубодис-персных примесей и придания воде прозрачности применяют фильтрование и отстаивание. Для освобождения от органических и минеральных коллоидно-дисперсных веществ воду подвергают коагуляции. Коагуляция достигается присадкой к воде электролитов, нейтрализующих заряд коллоидов, в результате чего коллоиды приобретают способность слипаться в более крупные частицы и выпадать под действием силы тяжести. Выпадаемые примеси удаляются в фильтрах и отстойниках. [24]
В разбавленном растворе коллоидальные частички увеличиваются весьма медленно, в концентрированном и в присутствии солей - быстро. При этом окраска изменяется в бурый цвет, а затем образуется буро-черный осадок. Подобно тому как ионы, заряд которых противоположен заряду коллоида, действуют на последний осаждающим образом, точно так же осаждаются коллоиды другими коллоидами, противоположно-заряженными. Образующийся при этом осадок состоит из смеси обоих коллоидов в количественных отношениях, меняющихся в зависимости от концентрации. Такого рода соединение двух коллоидов называют адсорбционным соединением коллоидов. [25]
Часто коагуляция коллоидов зависит от рН раствора. Это в основном относится к коллоидам, которые адсорбируют на своей поверхности анионы слабых кислот. ИОНОБ, происходит соединение Нойонов с анионами слабых кислот, заряд коллоида понижается и может быть уничтожен совсем. [26]
Интересен случай так называемых неправильных рядов, когда при переходе через изоэлектрическую точку осевший коллоид вновь растворяется, чтобы при дальнейшей прибавке электролита опять осесть. Примером может служить коагуляция Pt-золя посредством FeCls. При 0 00008 - 0 0002 моль / л РеС18 заряд отрицательного коллоида снимается и достигается изоэлектрическая точка с коагуляцией в ней. Дальнейшее прибавление Fe1 сообщает коллоиду ( - -) заряд, и, когда последний достаточно велик, начинается поглощение СР. При 0 016 моль / л заряды FeCl3 снова нейтрализуются и наступает вторичная коагуляция. [27]
Следовательно, коллоиды являются такими гетерогенными дисперсными системами, у которых на границе дисперсной фазы и дисперсионной среды имеется вещество, стабилизирующее коллоид. По своим физико-химическим свойствам оно связано с материалом коллоидных частиц, ибо обладает определенным сродством с ним и одновременно характеризуется истинной растворимостью в дисперсионной среде. Это вещество, названное Н. П. Песковым стабилизатором, диссоциируя на поверхности коллоидных частиц, обусловливает возникновение заряда коллоидов и, следовательно, создает стойкость коллоидных систем, сближая их по этому признаку с истинными растворами. [28]
Многие вещества приобретают свой заряд частично или полностью путем ионизации. Например, белки обязаны своим зарядом в значительной степени ионизации амино - и карбоксильной групп. Типичные лиофобные коллоиды состоят из трех частей: 1) ионогенного комплекса, ионизация которого является причиной заряда коллоида, 2) компенсирующих ионов, или, как они иногда называются, противоионов, которые отделяются от ионогенного комплекса и уравновешивают заряд на коллоидной частице, вследствие чего свободный заряд раствора в целом равен нулю, и 3) из нейтральной части, которая представляет незаряженное ядро частицы. Например, в золе золота Бредига, как полагают, АиС12Н является ионогенным комплексом. [29]
В данном случае наблюдается только неспецифическое проявление адсорбции на ребрах кристалла, что перекрывает специфическую адсорбцию катион-ных слоев на ребре. Кроме того, происходит осаждение на ребрах благодаря действию свободных валентностей. Схематически эти соотношения изображены на рис. 14.11. Из сравнения двух схем можно видеть, что адсорбирующее действие кромок ( ребер) не зависит от знака заряда осаждающихся коллоидов. На катионной поверхности ( слюда) наблюдаются противоположные адсорбционные эффекты. [30]
Страницы: 1 2 3