Заселение - орбиталь
Cтраница 1
Заселение орбиталей электронами происходит в соответствии с принципом минимума энергий, правилами Паули и Гунда. [1]
При заселении орбиталей с одинаковой энергией ( например, пяти З - орбиталей) электроны в первую очередь расселяются поодиночке на вакантных орбиталях, после чего начинается заселение орбиталей вторыми электронами. Это происходит в соответствии с правилом Гунда, согласно которому на орбиталях с одинаковой энергией электроны остаются по возможности неспаренными. Такая особенность объясняется наличием электрон-электронного отталкивания. При заселении набора из пяти d - орбиталей шестым электроном он вынужден спариваться с другим электроном, уже находящимся на какой-либо из орбиталей. Взаимное отталкивание отрицательно заряженных электронов приводит к тому, что для удаления ( ионизации) этого шестого электрона требуется меньшая энергия, чем для удаления одного из пяти электронов из полузаполненного набора пяти d - орбиталей. По аналогичной причине четвертый электрон, заселяющий набор из трех р-орбиталей, удерживается в атоме менее прочно, чем третий электрон. [2]
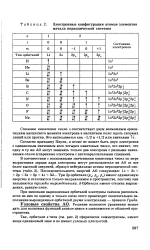 |
Электронные конфигурации атомов элементов начала периодической системы. [3] |
При заселении вырожденных орбиталей электроны сначала располагаются на них по одному и только после этого происходит окончательное заполнение вырожденных орбиталей двумя электронами - правило Гунда. [4]
В указанной последовательности заселения орбиталей наблюдаются две аномалии. Полузаполненная ( d5) и полностью заполненная ( d10) конфигурации особенно устойчивы, поэтому атомы хрома, Сг, и меди, Си, имеют только по одному 4х - электрону. [5]
Тот же самый принцип очередности заселения орбиталей дает для молекулы циклобутана: ( SS) 2 ( AS) 2 - основное состояние, ( SS) 2 ( AS) 1 ( SA) 1 - первое возбужденное состояние, ( SS) 2 ( AS) 1 ( AA) 1 - второе возбужденное состояние, ( SS) 2 ( SA) 2 - дважды возбужденное состояние. [6]
Перенос заряда в донорно-акцепторном комплексе приводит к заселению пустых орбиталей и к частичному освобождению полностью занятых уровней. При этом несвязывающие гили разрыхляющие взаимодействия превращаются в связывающие взаимодействия между частично занятыми орбиталямн. Энергия взаимодействия между молекулами, образующими кристалл, повышается, а расстояние между молекулами уменьшается. Это действительно наблюдается в большинстве комплексов с переносом заряда. [7]
Семейство элементов - совокупность элементов, в атомах которых заселение орбиталей наружных электронных оболЬчек осуществляется по одинаковому принципу. В соответствии с этим различают s -, p -, d - и / - семейства элементов. [8]
Семейство элементов - совокупность элементов, в атомах которых заселение орбиталей наружных электронных оболочек осуществляется по одинаковому принципу. В соответствии с этим различают s -, р -, d - и / - семейства элементов. [9]
Семейства элементов - совокупность различных элементов, в атомах которых заселение орбиталей наружных электронных оболочек осуществляется по одинаковому принципу. В соответствии с этим различают s -, р -, d - и / - семейства элементов. [10]
 |
Структура икосаэдрической элементарной ячейки бора, В12. В различных аллотропных формах кристаллического бора такие ячейки соединены друг с другом различными способами. [11] |
Атомы металлических элементов, как правило, имеют меньше валентных электронов, чем доступных для заселения орбиталей, другими словами, эти атомы являются электронно-дефицитными. Поэтому такие атомы имеют тенденцию обобществлять электронную плотность с несколькими другими атомами, осуществляя этим способом свои максимальные валентные возможности. В гексагональной плотноупакованной и кубической плотноупако-ванной структурах каждая сфера ( атом) соприкасается с 12 другими сферами, 6 из которых находятся в общей плоскости с данным атомом и еще 3 сверху и 3 снизу от нее. Методом рентгеноструктурного анализа установлено, что приблизительно две трети всех металлов кристаллизуются в одной из этих двух структур. Большая часть металлов из оставшейся трети кристаллизуется с образованием объемно-центрированной кубической структуры, где каждый атом окружен лишь восемью ближайшими соседями. [12]
Некоторое понижение кратности этой связи можно объяснить также уменьшением переноса электронной плотности с кислорода на Sd-орбитали серы вследствие конкуренции за заселение данных орбиталей с nd - орбиталей металла. Таким образом, проведенное качественное рассмотрение, а также результаты полуэмпирических квантово-химических расчетов указывают на некоторое рслабление связи S - О при координации ДМСО через серу. Увеличение же частоты валентного колебания в этом случае следует, по-видимому, связывать не с усилением указанной связи, а с усложнением силового поля, действующего на атом кислорода в частности за счет электростатического взаимодействия металл - кислород. [13]
При заселении орбиталей с одинаковой энергией ( например, пяти З - орбиталей) электроны в первую очередь расселяются поодиночке на вакантных орбиталях, после чего начинается заселение орбиталей вторыми электронами. Это происходит в соответствии с правилом Гунда, согласно которому на орбиталях с одинаковой энергией электроны остаются по возможности неспаренными. Такая особенность объясняется наличием электрон-электронного отталкивания. При заселении набора из пяти d - орбиталей шестым электроном он вынужден спариваться с другим электроном, уже находящимся на какой-либо из орбиталей. Взаимное отталкивание отрицательно заряженных электронов приводит к тому, что для удаления ( ионизации) этого шестого электрона требуется меньшая энергия, чем для удаления одного из пяти электронов из полузаполненного набора пяти d - орбиталей. По аналогичной причине четвертый электрон, заселяющий набор из трех р-орбиталей, удерживается в атоме менее прочно, чем третий электрон. [14]
Вследствие того что 45-орбиталь проникает ближе к ядру, чем З - орбиталь, процесс заселения орбиталей должен осуществляться с учетом того, что 4з - орбиталь имеет несколько более низкую энергию, чем З - орбиталь. [15]
Страницы: 1 2