Затрудненность - вращение
Cтраница 1
 |
Ультрафиолетовые спектры поглощения амидов в растворе. [1] |
Затрудненность вращения вокруг связи С ( О) - N ( см. разд. [2]
Затрудненность вращения вокруг простых связей объясняет устойчивость шахматных ( продолженных) конформаций сопряженных молекул. Было также показано, что гранс-кон-фигурация относительно простой связи устойчива и в случае сопряженных молекул меньших размеров, таких, как бутадиен-1 3, глиоксаль и оксалилхлорид. В этих молекулах транс-конфигурация стабилизируется как сопряжением, так и благоприятной азимутальной ориентацией относительно простой связи, в то время как двум скошенным конформациям благоприятствует ориентация, но не благоприятствует сопряжение, а цис-конфигурации благоприятствует сопряжение, но не ориентация. Предсказанное различие в энергиях цис - и транс-конфигураций может быть определено из высот барьеров в других веществах; для углеводородов оно оказывается равным примерно 1 5 ккал / моль. [3]
Затрудненность вращения вокруг простых связей объясняет устойчивость шахматных ( продолженных) конформаций сопряженных молекул. Было также показано, что транс-конфигурация относительно простой связи устойчива и в случае сопряженных молекул меньших размеров, таких, как бутадиен-1 3, глиоксаль и оксалилхлорид. В этих молекулах транс-конфигурация стабилизируется как сопряжением, так и благоприятной азимутальной ориентацией относительно простой связи, в то время как двум скошенным конформациям благоприятствует ориентация, но не благоприятствует сопряжение, а цис-конфигурации благоприятствует сопряжение, но не ориентация. Предсказанное различие в энергиях цис - и транс-конфигураций может быть определено из высот барьеров в других веществах; для углеводородов оно оказывается равным примерно 1 5 ккал / моль. [4]
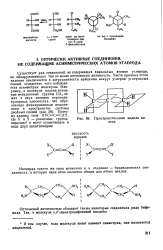
Дифенилдиазокетон ( XXXII) обладает оптической активностью, обусловленной затрудненностью вращения вокруг связи, соединяющей два фенильных ядра. [5]
Справедливость предложенных моделей этиленовой связи в известной мере подтверждается затрудненностью вращения вокруг нее, в результате чего алкены, содержащие различные заместители у каждого из углеродных атомов, участвующих в образовании двойной связи, могут существовать в двух различных изомерных формах. Такие формы называют геометрическими изомерами; в простейших случаях-это цис - и трансизомеры. [6]
Справедливость предложенных моделей этиленовой связи в известной мере подтверждается затрудненностью вращения вокруг нее, в результате чего алкены, содержащие различные заместители у каждого из углеродных атомов, участвующих в образовании двойной связи, могут существовать в двух различных изомерных формах. Такие формы называют геометрическими изомерами; в простейших случаях - это цис - и трансизомеры. [7]
Существование циклогексана с такой конформацией обусловливается, по их мнению, затрудненностью вращения вокруг связей С-С даже при отсутствии байеровского напряжения. Лэнгсет и Бак изучали Раман-спектр жидкого циклогексана, но Шомейкер и Стивенсон [42] тотчас же указали, что этот вывод противоречит совокупности результатов, полученных при изучении циклогексана в газовой и твердой фазе, и что молекулы в этих фазах не должны значительно отличаться по своему строению от молекул в жидкой фазе. Коль-рауш и Виттек [43] показали через год, что Раман-спектроскопиче-ские данные для циклогексана согласуются именно с его кресельной, а не плоской конформацией и что выводы Лэнгсета и Бака основаны на ошибочной методике. Конечно, относительно конформационного состава производных циклогексана более полные выводы были сделаны значительно позднее, да и сами эти выводы имели более усложненный характер ( стр. [8]
ЯМР-спектроскопия гидроксамовых кислот исследована мало, и основное внимание здесь уделено вопросу о затрудненности вращения группы NOR в замещенных соединениях. [9]
Судя по молекулярным моделям, причиной асимметрии разделенных на оптические антиподы триарилстибинов VII и VIII не может быть затрудненность пространственного вращения ароматических радикалов, связанных с атомом сурьмы. Невозможность изолировать энантиомеры для сходно построенных триариламинов, наряду с обнаруженной значительной оптической устойчивостью стибинов, позволяет предполагать, что влияние пространственных затруднений в азотистых соединениях снимается быстрой инверсией пирамидальной конфигурации, тогда как для триарилстибинов барьер инверсии значительно выше [67] ( ср. [10]
В первом случае, по оценке Полинга, барьер очень мал, вероятно, меньше, чем 0 001 ккал / моль, во втором - должна была бы иметь место значительная затрудненность вращения двух метальных групп с высотой барьера около 0 25 ккал / моль и устойчивой затененной конформацией [ там же, стр. [11]
 |
Пространственная модель аллена. [12] |
Существует ряд соединений, не содержащих хиральных атомов углерода, но обнаруживающих тем не менее оптическую активность. Часто причина этого явления заключается в затрудненности вращения вокруг углерод - углеродных связей, вследствие чего наблюдается асимметрия молекулы. [13]
Если, напротив, считать конформацию LXXVI положением с низкой энергией для одиночной мотильной группы, то взаимодействие, отраженное на рис. 15 для 1 ис-бутена-2, несколько увеличивает энергию потенциального минимума, а энергия максимума не изменяется. Это соответствует известному факту, что затрудненность вращения в мс-бутене меньше, чем в пропилене и тпрякс-бутене, и энергосодержание его выше. [14]
На основании данных колебательных спектров установлено, что порядок связи S - N в простых метилированных моно - и ди-сульфенамидах значительно больше единицы. На увеличенный порядок связи указывает также температурная зависимость спектров ЯМР, поскольку она обусловлена затрудненностью вращения вокруг связи S - N и ( или) затрудненностью инверсии у атома азота. На основании изучения температурной зависимости спектров ЯМР ряда циклических и ациклических сульфенамидов предполагают, что инверсия у атома азота является стадией, определяющей скорость реакции только у производных азиридина. Барьеры вращения вокруг связей S - N в соединениях типа ( 38) равны 55 - 85 кДж / моль и определяются совокупностью взаимодействий между свободными парами электронов, увеличенным порядком связи S - N и пространственными влияниями. В этой системе вклад кратного характера связи S - N становится значительным только для соединений, у которых заместитель X представляет собой электроноакцепторную группу. На основании рент-геноструктурного анализа сульфенамида ( 39) установлено, что связи у атома азота лежат почти в одной плоскости, что обусловлено рл - л-взаимодействиями между 5р2 - гибридизованным атомом азота и электронодефицитным атомом серы. [15]
Страницы: 1 2