Парциальная мольная величина - компонент
Cтраница 1
Парциальные мольные величины компонентов, образующих раствор, связаны между собой двумя уравнениями. [1]
 |
К понятию о парциальных молярных величинах. [2] |
Парциальные мольные величины компонентов раствора взаимосвязаны. Так, если известна зависимость давления пара одного из компонентов бинарного раствора от его концентрации, то можно вычислить давление пара другого компонента. Это позволяет су-щественно сократить число экспериментальных определений, необходимых для термодинамической характеристики растворов. [3]
Парциальные мольные величины компонентов бинарной системы по-разному изменяются с уменьшением концентрации примеси. [4]
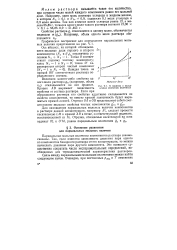
Таким образом, парциальные мольные величины компонентов в бинарном растворе могут быть получены с помощью касательных, проведенных к кривым g - ХА или g - хс для данного состава. [5]
Таким образом, все три рассмотренные парциальные мольные величины компонентов в критической точке азеотропа имеют особенность - они стремятся к бесконечности, причем закон приближения к бесконечности для всех них одинаков. Именно поэтому химический потенциал в критической точке азеотропа особенности не имеет. [6]
Эти уравнения устанавливают зависимость между парциальными мольными величинами компонентов, образующих раствор, и поэтому находят большое применение в термодинамике растворов. [7]
При помощи уравнений Гиббса - Дюгема устанавливается связь между изменениями парциальных мольных величин компонентов в растворе. [8]
С помощью уравнений Гиббса - Дюгема устанавливается связь между изменениями парциальных мольных величин компонентов раствора. [9]
Уравнения типа ( 1.23.) и (1.25) показывают связь между парциальными мольными величинами компонентов данной сложной системы. [10]
Таким образом, любое экстенсивное свойство раствора может быть найдено сложением произведений парциальных мольных величин компонентов на соответственные числа их молей. [11]
Таким образом, разность между мольным количеством Gc чистого компонента С и парциальной мольной величиной Gc компонента С в растворе состава ХА можно получить по величине от - резка, отсекаемого на оси ординат касательной, проведенной к кривой А - хд в точке ХА. [12]
IV, § 4 показан общий способ расчета любого экстенсивного свойства раствора. Расчет основан на представлении о парциальных мольных величинах компонентов. [13]
Уравнение ( 7 - 16) дает выражение парциальной мольной величины для всех компонентов, кроме С. Уравнение ( 7 - 15) дает выражение парциальной мольной величины компонента С. [14]
Соблюдение условий, требуемых этим определением, может быть достигнуто, если, например, к весьма большому объему раствора данной концентрации при постоянных робщ и Т добавить 1 моль какого-либо компонента. В этом случае концентрация раствора практически не изменится и соответствующее изменение свойства раствора будет парциальной мольной величиной добавленного компонента. [15]
Страницы: 1 2