Значение - порядок - реакция
Cтраница 1
Значение порядка реакции равно примерно 1 и совпадает с предсказанным на основе теоретических рассуждений. [1]
Следует, однако, отметить, что значения порядка реакции, полученные с помощью двух рассмотренных методов, не всегда согласуются между собой. Это объясняется тем, что на начальную скорость реакции не оказывают влияния промежуточные продукты реакции, существенно влияющие на скорость ее протекания. Напротив, метод времени полупревращения учитывает влияние промежуточных веществ. [2]
В этом случае можно ожидать, что значения порядка реакции по водороду и энергии активации для указанных процессов различны. Этим и объясняется зависимость хмлкс от давления и температуры. В, рамках обсуждаемого допущения из данных табл. 8.7 следует, что для процесса образования ядер наблюдаемые значения порядка реакции по водороду больше, а энергии активации меньше, чем значения этих величин для реакции на поверхности раздела твердых фаз. [3]
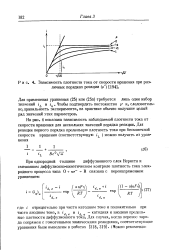 |
Зависимость плотности тока от скорости вращения при раз личных порядках реакции ( р. [4] |
На рис. 4 показана зависимость наблюдаемой плотности тока от скорости вращения для нескольких значений порядка реакции. [5]
Единственное различие состоит в следующем: раньше производные dt - L / dt в ряде точек позволяли определить набор значений порядка реакции а, подвергавшийся затем усреднению, а теперь эти производные определяют набор отношений ф ( С) / ф ( Cj), позволяющий вычислить функцию ф ( С) с точностью до множителя. [6]
Кроме того, Дар подтвердил вывод Хальбана [246] об уменьшении температурного коэффициента с увеличением порядка реакции, причем присутствие катализатора не изменяет значения порядка реакции, а также заметил слабое влияние нейтральных солей на величину температурного коэффициента. [7]
Крайне необходимо, чтобы каждый изучающий кинетику реакций углерода с газами понимал, какое влияние могут оказывать эти стадии процесса ( отдельно или вместе) на значения порядка реакций, энергий активации и скоростей реакций. Зиил [100], Уилер [101, 102], Вейц и Пратер [103] и Франк-Каменецкий [104] сделали очень много в области катализа для понимания роли, которую играют совместно 2-я и 3-я стадии. В этом разделе при обсуждении кинетики реакций углерода с газами будут использованы их концепции. [8]
Соответственно увеличивается и константа скорости. Значение порядка реакции не зависит от состава смеси, процесс термодеструкции остатков КГК и их смесей с Г АН соответствует реакции первого порядка. [9]
Для быстрого установления порядка реакции Швабе [97] рекомендует очень удобные графики, где на одной из осей отложены значения отношения текущей концентрации к начальной, которое во многих случаях можно заменить отношением соответствующих высот полярографических волн, а на другой оси - значение логарифма времени. Каждому значению порядка реакции соответствует определенная кривая, позволяющая по нескольким точкам установить порядок исследуемой реакции. [10]
Порядок реакции по бензолу оказывается нулевым только при низких температурах, приблизительно до 100 С, а затем растет и постепенно приближается к 0 5 при температурах около 200 С. Что касается значений порядка реакции по водороду, то он составляет при низких температурах около 0 5 и постепенно возрастает до единицы при высоких температурах, что связано с изменением значений адсорбционных коэффициентов с температурой. Продукт реакции - циклогексан - тормозит процесс только в небольшой степени. [11]
Исследованы кинетические закономерности реакций каркасных субстратов с азотной кислогой. Определение порядка реакции по адамантану показало переход значения порядка реакции от нулевого к дробному и далее к первому при увеличении концентрации азотной кислоты, что связано со сменой лимитирующей стадии процесса. Изучение влияния различных добавок на нитроксилирование адамантана позволило установить, что скорость сильно зависит от факторов, влияющих на равновесие автопро-толиза азотной кислоты. [12]
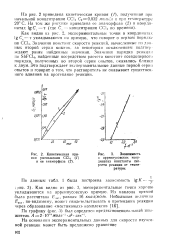 |
Кинетическая кривая уменьшения ССЦ ( 1 и ее анаморфоза ( 2. [13] |
Как видно из рис. 2, экспериментальные точки в координатах lgCr - т укладываются на прямую, что говорит о первом порядке по ССЦ. Значения констант скорости реакций, вычисленные из данных второй серии опытов, за некоторым исключением подтверждают ранее найденные значения. Значения порядка реакции по SbFCl4, найденные посредством расчета констант псевдопервого порядка, полученных во второй серии опытов, оказались близки к двум. Это подтверждает экспериментальные данные первой серии опытов и говорит о том, что растворитель не оказывает существенного влияния на протекание реакции. [14]
В обоих случаях скорость реакции прямо пропорциональна концентрации катализатора. Порядок реакции по исходным веществам различен и принимает значение, равное единице или двум. Вне указанных предельных случаев значение порядка реакции лежит между единицей и двумя. [15]
Страницы: 1