Отрицательное значение - электродный потенциал
Cтраница 1
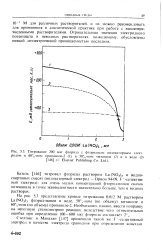 |
Титрование 200 мкг фторида с фторидным индикаторным электродом в 60 % - ном пропаноле-2 ( /, в 50 / - ном метаноле ( 2 и в воде ( 3 ( г Elsevier Publishing Co. Ltd.. [1] |
Отрицательные значения электродного потенциала в неводных растворителях, по-видимому, обусловлены низкой диэлектрической проницаемостью последних. [2]
Почему, несмотря на отрицательные значения электродных потенциалов, эти металлы при обычных условиях не взаимодействуют ни с водой, ни с разбавленной серной кислотой. [3]
Для катодного покрытия выбирают металлы, имеющие менее отрицательное значение электродного потенциала. До тех пор, пока катодное покрытие полностью изолирует металл от контакта с агрессивной средой, изделие не подвергается коррозии. [4]
Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл. Пока катодное покрытие полностью изолирует металл от контакта с агрессивной средой, он не подвергается коррозии. Катодными покрытиями служат медь, олово, свинец, никель и др. Всякое защитное металлическое покрытие должно быть сплошным. [5]
Стремление атомов металла перейти в раствор определяется величиной отрицательного значения электродного потенциала. Из двух металлов, находящихся в контакте, будет корродировать тот металл, у которого электродный потенциал в данном растворе более электроотрицателен, и он является анодом. Второй электрод, более электроположительный, является катодом. Процесс электрохимической коррозии может быть представлен следующим образом ( фиг. [6]
Какой эксперимент позволяет быстро определить, имеет ли данный металл положительное или отрицательное значение электродного потенциала. [7]
Металлы подгруппы 3В и IV периода, за исключением меди, и кадмий имеют отрицательное значение электродного потенциала, и потому растворяются в кислотах с выделением водорода. Все остальные металлы окисляются азотной кислотой, а некоторые из них - только царской водкой или смесью плавиковой и азотной кислот. [8]
Все щелочные металлы - очень сильные восстановители, их стандартные электродные потенциалы f отрицательные и имеют большое абсолютное значение. Литий имеет наибольшее отрицательное значение электродного потенциала ( - 3 045 В), соответствующее потенциалу окислительно-восстановительной пары LiVU в водном растворе. [9]
Все щелочные металлы - очень сильные восстановители, их стандартные электродные потенциалы ip отрицательные и имеют большое абсолютное значение. Литий имеет наибольшее отрицательное значение электродного потенциала ( - 3 045 В), соответствующее потенциалу окислительно-восстановительной пары Li4 / 1л в водном растворе. [10]
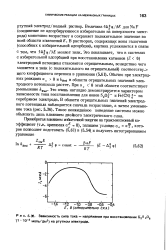 |
Зависимость сила тока - напряжение при восстановлении K2S 20g ( 1 Ю-3 моль / дм3 на ртутном электроде. [11] |
ЭД ф / ЭЯ меняет знак. Обычно при электродных реакциях о с 0 и & Red в области отрицательных значений электродного потенциала растет. Это очень наглядно демонстрируется характером зависимости тока восстановления для ионов S20f - и Fe ( CN) l - на серебряном электроде. [12]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов ОНз отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - - V2H2 ( r), поэтому число металлов, взаимодействующих по этому механизму, резко увеличивается. [13]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов OHJ отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - 1 / 2Н3 ( г), поэтому число металлов, взаимодействующих по этому механизму, резко увеличивается. [14]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов ОНз отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - V2H2 ( r), поэтому число металлов. [15]
Страницы: 1 2