Вычисленное значение - константа
Cтраница 1
Вычисленные значения констант А и В дают возможность рассчитать зависимость от состава как активности обоих компонентов карбидной фазы, так и других термодинамических величин ( AZ, Д т, A Si), определить предельную растворимость графита в карбиде, а также предсказать направление изменения конгруэнтно испаряющегося состава с температурой. [1]
Вычисленные значения константы равновесия достаточно постоянны и хорошо совпадают с величиной, найденной из равновесия гидролиза тетрафтороборатов. Это подтверждает, что HBF4 и HBF3OH в растворах диссоциированы практически полностью или, по крайней мере, в одинаковой степени. Только в наиболее концентрированных растворах ( М00 6) начинается постепенное возрастание вычисленной величины константы равновесия. [2]
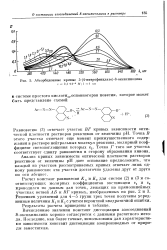 |
Абсорбционные кривые 5 - ( 4-нитрофенилазо - 8-оксихинолина. [3] |
Вычисленные значения констант диссоциации азосоединений 8-оксихинолина хорошо согласуются с данными расчетного метода. Последние, как более точные, использованы для характеристики зависимости констант диссоциации азопроизводных от природы заместителя. [4]
Ниже приведены вычисленные значения констант равновесия реакции ( V-2) [ константы равновесия реакции ( V-1) см. стр. [5]
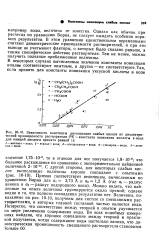 |
Зависимость константы диссоциации слабых кислот от диэлектрической проницаемости растворителя ( № К. - константа ионизации кислоты в воде для каждой кислоты принята равной 1. [6] |
В некоторых случаях вычисленные значения константы ионизации вполне соответствуют опытным, в других - не соответствуют. [7]
В табл. 5.2.1 приведены вычисленные значения констант сжимаемых горных пород с изотропным линейным упрочнением. [8]
Как видно из таблицы 1, нами вычисленные значения констант Ki и Кг уравнения И. Р. Кричевского и Я. С. Казарновского очень близки к экспериментальным значениям этих констант несмотря па возможные неточности в определении энергий взаимодействия ( Q) газовых молекул с молекулами растворителя. [9]
Как видно из результатов расчета ( табл. 1), вычисленные значения констант довольно близки. При этом следует принять во внимание, что отношение концентраций NaCl и НС1 в первых двух сериях опытов изменялось от 0 до 19, а в третьей серии - от 0 до 50; величина ионной силы изменялась в третьей серии в 50 раз. [10]
Последнее соображение, которое часто приводят для различных жидких систем, основано на вычислении константы скорости лимитируемого диффузией процесса по уравнению Дебая [231] ( см. разд. Вычисленные значения константы диффузии для бензола и хлороформа при 20 равны 1 0 - 1010 и 1 1 - 1010 л / моль-сек соответственно. Величину примерно К) 10 полезно запомнить как бимолекулярную константу скорости лимитируемого диффузией процесса в подвижных жидкостях при комнатной температуре. [11]
Этот резонанс полностью подавляется при присоединении протона к атому азота. Соответствующее вычисленное значение константы основности 1 10 - 20 так мало, что единственный вывод, который можно сделать, сводится к тому, что амиды не должны давать солей с кислотами за счет присоединения протона к аминогруппе. Относительно конфигурации и размеров амидной группы данных нет. [12]
Как видно из рис. 6.2, экспериментальные кривые дегидрохлориро-вания ХБК удовлетворительно совпадают с расчетными. Вычисленные значения константы реакции элиминирования НС1 из структур ( 2) и ( 3) ( см. табл. 6.4) в пределах ошибки опыта совпадают для образцов ХБК с различным содержанием хлора. [13]
Таким образом, уравнения (XI.7), (XI.8) и (XI.12) показывают следующее: если заданные ( не равновесные. Тогда нахождение оптимальной температуры процесса сведется к выяснению того, какой температуре отвечает вычисленное значение константы равновесия. [14]
Для вычисления этой константы использовали значения ks приведенные в табл. 84, в сочетании с величинами первой константы гидролиза лутео-иона, которые, согласно данным табл. 78 и 80, можно считать правильными для данных ионных сил. Наконец, в последних двух колонках табл. 84 представлены значения k6 и Ig & e, рассчитанные на основании сказанного выше. При рассмотрении вычисленных значений шестой константы устойчивости, видно, что lgks растет приблизительно линейно с увеличением концентрации соли. [15]
Страницы: 1 2