Высокое значение - потенциал - ионизация
Cтраница 1
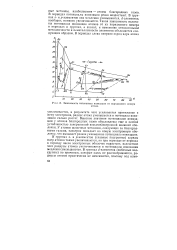 |
Зависимость потенциала ионизации от порядкового номера. [1] |
Высокие значения потенциалов ионизации у атомов благородных газов обусловлены еще и особой устойчивостью завершенной восьмиэлектронной внешней оболочки. У атомов щелочных металлов, следующих за благородными газами, электрон попадает на новую электронную оболочку, что вызывает резкое уменьшение потенциала ионизадии. В группах s - и р-элементов ( главные подгруппы) заряды ядер атомов также увеличиваются, но при переходе от периода к периоду число электронных оболочек нарастает, вследствие чего радиусы атомов увеличиваются и потенциалы ионизации медленно уменьшаются. [2]
 |
Потенциалы ионизации атомов элементов 1-го и 2-гопериодов. [3] |
Высокие значения потенциалов ионизации, отвечающих удалению четырех, пяти, шести электронов, объясняют, почему ионы с такими зарядами ( например, Сг6) не встречаются в практике химика. Появление такого иона в водном растворе вызвало бы немедленное взаимодействие его с молекулами воды, в результате чего образовался бы анион соответствующей кислородной кислоты. [4]
Высокие значения потенциалов ионизации цинка приводят к тому, что ковалентное взаимодействие его ионов проявляется значительно сильнее, чем у других ионов. Ион цинка играет большую роль в биосистемах, входит во многие ферменты в качестве необходимой составной части. [5]
Этим обстоятельством объясняется и упоминавшееся выше явление обращения рядов устойчивости аммиакатов у элементов с высокими значениями потенциалов ионизации и то, что теплота гидратации солей элементов побочных групп всегда ниже, чем солей главных групп, и, наконец, то, что теплота образования аммиакатов иодидов элементов главных групп периодической системы всегда больше, чем у иодидов элементов побочных групп. [6]
Атомы элементов нулевой группы - благородных газов - имеют всегда полностью заполненные орбитали и обнаруживают самые высокие значения потенциалов ионизации в каждом из периодов. Атомы щелочных металлов, образующих первую группу периодической системы, имеют по одному s - электрону и обнаруживают самые низкие значения ПИ в каждом из периодов. [7]
В то же время стирол и метилметакрилат не полимеризуются при диспергировании Сг и W, вероятно, вследствие высоких значений потенциалов ионизации. [8]
Si, Sb и др. В то же время стирол и метилметакрилат не полимеризуются при диспергировании Сг и W, вероятно, вследствие высоких значений потенциалов ионизации. [9]
При взаимодействии по второму типу ( в системах металл ( донор) - углерод ( акцептор)), атомы металлов, обладающие высокими значениями потенциалов ионизации, приобретают электроны атомов углерода, становясь при этом отрицательными ионами различного заряда, а углерод соответственно приобретает положительный заряд. Примером таких систем является взаимодействие с углеродом металлов подгруппы с VIII группы ( Ni, Pd, Pi) и некоторых металлов других подгрупп этой группы. [10]
У марганца в связи с устойчивостью наполовину заполненной й10 - оболочки, состоящей из пяти электронов с параллельными спинами ( конфигурация d5), и высокими значениями потенциалов ионизации отделение всех семи валентных электронов при образовании кристаллической структуры оказывается уже невозможным. По-видимому, свободными электронами в металлическом состоянии могут стать не более двух электронов с внешнего s - уровня. При низких температурах марганец образует сложные не типичные для металлов хрупкие структуры. В интервале 727 - 1095 стабилен ( 5 - Мп, имеющий сложную плотную кубическую упаковку с 20 атомами в элементарной ячейке. Такой тип структуры имеют многие электронные фазы с электронной концентрацией 3 / 2, например AgHg. Между 1134 и температурой плавления ( 1244) существует объемноцен-трированная кубическая модификация б - Mn. Марганец, помимо устойчивых соединений, где он двухвалентен, образует, хотя и менее устойчивые, одновалентные соединения. [11]
Дуга в среде аргона горит при напряжении 12 - И5 в, но для ее возбуждения необходимо напряжение 200 - 250 в, что вызвано высоким значением потенциала ионизации аргона в сравнении с азотом и кислородом. [12]
Дуга в среде аргона горит при напряжении 12ч - 15 в, но для ее возбуждения необходимо напряжение 200 - 250 в, что вызвано высоким значением потенциала ионизации аргона в сравнении с азотом и кислородом. [13]
Распространение представлений Убеллоде на карбиды, нитриды и особенно моноокислы переходных металлов встречает значительные трудности вследствие того, что углерод, азот и особенно кислород представляют гораздо более электроотрицательные элементы, нежели водород, и высокие значения потенциалов ионизации их внешних р-электронов делают маловероятным захват этих электронов на d - уровни переходных металлов. Кроме того, существует непрерывный переход от ионных соединений щелочных и щелочноземельных металлов к металлоподобным соединениям d - и / - переходных металлов с той же решеткой каменной соли. [14]
С другой стороны, бор, находящийся слева от границы Цинтля, обладающий дефицитом валентных электронов, в виде простого вещества характеризуется неметаллическими свойствами. Из-за кайносимметричности 2 / 0-орбитали и вследствие этого высоких значений потенциала ионизации и электроотрицательности бора имеет место затруднение к обобществлению электронов в пределах всего кристалла. В силу дефицита валентных электронов в кристаллических модификациях бора наблюдается их обобществление, которое ограничено локальными атомными группами. [15]
Страницы: 1 2