Скорость - разложение - перекись - водород
Cтраница 2
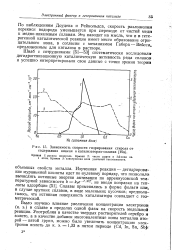 |
Зависимость скорости гидрирования стирола от содержания никеля в катализаторах-сплавах [ 49а ]. [16] |
По наблюдениям Доудена и Рейнольдса, скорость разложения перекиси водорода уменьшается при переходе от чистой меди к медно-никелевым сплавам. Это наводит на мысль, что и ff гетерогенной каталитической реакции имеет место образование отрицательного иона, в согласии с механизмом Габера - Бевсса, предложенным для катализа в растворе. [17]
 |
Прибор для разложения перекиси водорода. [18] |
По данным опыта построить кривую зависимости скорости разложения перекиси водорода от времени: ось абсцисс-время ( масштаб: 1 мин. [19]
Как видно из табл. 9.1 [64], в нейтральных растворах мономолекулярная константа скорости разложения перекиси водорода пропорциональна концентрации иодид-ионов. Таким образом, сколько-нибудь заметный катионный эффект отсутствует. Такие эффекты часто встречаются в сольволитических реакциях, однако в бимолекулярных процессах они обнаруживаются редко. [20]
При применении свинца в качестве конструкционного материала для дестилляциошюй аппаратуры скорость дестилля-ним больше скорости разложения перекиси водорода на свинце. Малому выходу способствовало также и то, что патрубок для отвода парон перекиси водорода и холодильник для них были также изготовлены из свинца; под действием же перекиси водорода в отсутствие серной кислоты свинец быстро разрушается. [21]
Проведенные эксперименты показывают, что образцы, содержащие на поверхности координированный пиридин, увеличивают скорость разложения перекиси водорода. Скорость проходит через максимум. Это, вероятно, связано с уменьшением концентрации активных центров ( Со 2 -ионы), так как стабилизируются Со3 - ионы, а при больших концентрациях пиридина координация происходит на пятое и шестое место, что мешает доступу молекул перекиси к иону кобальта. [22]
Это напоминает описанное выше обратное явление, касающееся влияния смеси двух катализаторов, в случае которого скорость разложения перекиси водорода также была больше аддитивной величины. Очевидно, необходимо, чтобы рН раствора перекиси водорода находился в интервале, в котором каждый отдельный стабилизатор является эффективным. [23]
В чистых растворах перекиси водорода по мере увеличения их концентрации возрастает как скорость коррозии титана, так и скорость разложения перекиси водорода. За 360 ч испытания почти полностью разлагаются 30 и 60 % растворы, при этом 60 % раствор превращается в прозрачный гель. [24]
Примерами отрицательного катализа является замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта, сильное уменьшение скорости разложения перекиси водорода в присутствии небольших количеств серной кислоты ( 0 0001 мае. [25]
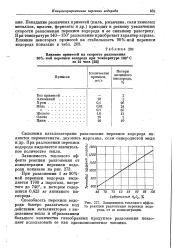 |
Зависимость теплового эффекта реакции разложения перекиси водорода от ее концентрации. [26] |
Попадание различных примесей ( пыль, ржавчина, соли тяжелых металлов, щелочи, ферменты и др.) приводит к резкому увеличению скорости разложения перекиси водорода и ее сильному разогреву. При температуре 140 - 150 разложение приобретает характер взрыва. [27]
Хотя электропроводность растворов перекиси водорода или воды, применяемой для их разбавления, часто принимается за показатель чистоты, необходимо подчеркнуть, что скорость разложения перекиси водорода с малой электропроводностью может быть иногда значительной, особенно при повышенных температурах, например при ускоренных испытаниях па стабильность или при генерировании пара. Предполагается, что эта значительная скорость разложения вызвана присутствием веществ в коллоидном состоянии, не влияющих па электропроводность. Обычно причиной возникновения таких трудностей является недостаточное внимание к качеству дистиллированной воды. [28]
Изучено влияние К - Na солей тетрасульфофталоцианинов Со11, V111, Реш, Сгш на поляризацию при анодном выделении кислорода в щелочной среде и скорость разложения перекиси водорода. [29]
С этой целью на предварительно покрытую золотом пластинку последовательно электролитически наносились гладкие слои платины, и после нанесения каждого слоя вышеописанным способом определялась константа скорости разложения перекиси водорода. [30]
Страницы: 1 2 3 4