Образующийся ангидрид
Cтраница 1
Образующийся ангидрид далее гидролизуется до УМФ и серина. [1]
Количество образующегося ангидрида сульфоновой кислоты увеличивается с увеличением избытка серного ангидрида, применяемого для сульфирования. [2]
К колбе присоединяют холодильную трубку и отгоняют образующийся ангидрид на пламени спиртовки. Сперва колбу нагревают осторожно, затем нагревание усиливают. Так как ангидрид обычно получается все же с примесью хлористого ацетила, к ди стилляту прибавляют 0 5 - 1 г порошка уксуснокислого натрия, чтобы полностью превратить хлористый ацетил в ангидрид, и снова перегоняют или же сохраняют его с примесью этой соли. Препарат обладает запахом уксусной кислоты. Хранят его в плотно закупоренной склянке. [3]
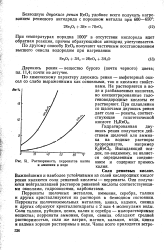 |
Растворимость перренатов калия и аммония в воде. [4] |
При температурах порядка 1000 в отсутствии кислорода идет обратная реакция, причем образующийся ангидрид улетучивается. [5]
Реакцию, конечно, можно распространить и на другие углеводороды при условии, что образующийся ангидрид стабилен в условиях окисления. В случае аценафтенов окисление, по-видимому, протекает через стадию дикетона; это обсуждается в разд. [6]
Для этого кислота должна кипеть при как можно более низкой температуре по сравнению с образующимся ангидридом. [7]
Для этого температура кипения кислоты должна быть как можно более низкой по сравнению с образующимся ангидридом. Поэтому чаще всего в качестве водоотнимающего средства используют относительно дешевый ацетангидрид. [8]
Так, если перемешивать при комнатной температуре М - карбобензокси-о ь - фенилалании и ДЦК в эфире, то наряду с дициклогексилмочевиной осаждается образующийся ангидрид. [9]
Если бы превращение было целиком направлено в сторону образования ацетанилида, в реакционной среде не должен был бы накапливаться ангидрид, так как, согласно предложенной схеме, количество образующегося ангидрида полностью расходуется. [10]
Растворимость аминокислоты в органических растворителях увеличивается в присутствии органических катионов. Образующийся ангидрид легко реагирует с аминогруппой второй аминокислоты. Однако аминогруппа способна реагировать с одной из двух карбонильных групп, так что может образоваться значительное количество побочного продукта. Этого можно избежать, если синтезировать смешанный ангидрид, нуклеофильная атака которого проходит предпочтительно по одному из двух карбонилов. К образованию такого ангидрида приводит реакция аминокислоты с этиловым эфиром хлоругольной кислоты. В этом случае атаке подвергается только одна карбонильная группа как более электрофильная ( ко второй карбонильной группе с обеих сторон примыкают два атома кислорода, делокализую-щих свои неподеленные электроны) и худшая уходящая группа. [11]
Для получения хорошего выхода карбоновую кислоту [ RCOOH в схеме ( 336) ] необходимо постоянно удалять отгонкой из реакционной смеси. Для этого кислота должна кипеть при как можно более низкой температуре по сравнению с образующимся ангидридом. Поэтому чаще всего в качестве водоотнимающего средства используют уксусный ангидрид, который к тому же и дешев. [12]
Двухосновные кислоты с карбоксилами в положениях 1 4 и 1 5 даже при простом нагревании теряют молекулу воды и превращаются в ангидриды. Вода выделяется в результате внутримолекулярного взаимодействия обеих карбоксильных групп за счет гидроксилов каждой из них, и образующиеся ангидриды имеют циклическое ( кольчатое) строе -, ние. [13]
Однако Диль [602] считает, что ацилмочевина не является достаточно активированным соединением. С другой стороны, Шюсслеру и Цану [1988] удалось показать, что реакционная способность симметричных ангидридов карбобензоксиаминокис-лот и карбобензоксипептидов достаточна для образования пептидной связи в условиях карбодиимидного синтеза. Однако механизм реакции, включающий стадию образования симметричного ангидрида, может вызывать сомнение ввиду ряда противоречивых данных. Так, при синтезе пептидов с использованием ациламинокислот, например формил - [2073] или трифторацетиламинокислот [2497], не было отмечено рацемизации. Однако в этом случае следовало бы ожидать рацемизацию при аминолизе промежуточно образующихся ангидридов ввиду возможности легкого образования азлактонов, так как формил - и трифторацетиламинокислоты непосредственно применяют для синтеза азлактонов ( [1633, 2117], см. гл. Влияние температуры и природы растворителя на процесс рацемизации изучили Андерсон и Каллахан [47] на примере реакции N, N - дициклогексилкарбодиимида с СЬо-Gry-L-Phe-OH и этиловым эфиром глицина. [14]
Однако Диль [602] считает, что ацилмочевина не является достаточно активированным соединением. С другой стороны, Шюсслеру и Цану [1988] удалось показать, что реакционная способность симметричных ангидридов карбобензоксиаминокис-лот и карбобензоксипептидов достаточна для образования пептидной связи в условиях карбодиимидного синтеза. Однако механизм реакции, включающий стадию образования симметричного ангидрида, может вызывать сомнение ввиду ряда противоречивых данных. Так, при синтезе пептидов с использованием ациламинокислот, например формил - [2073] или трифторацетиламинокислот [2497], не было отмечено рацемизации. Однако в этом случае следовало бы ожидать рацемизацию при аминолизе промежуточно образующихся ангидридов ввиду возможности легкого образования азлактонов, так как формил - и трифторацетиламинокислоты непосредственно применяют для синтеза азлактонов ( [1633, 2117], см. гл. Влияние температуры и природы растворителя на процесс рацемизации изучили Андерсон и Каллахан [47] на примере реакции N, N - дициклогексилкарбодиимида с СЬо-G. [15]
Страницы: 1