Изменение - концентрация - водородный ион
Cтраница 1
Изменение концентрации водородных ионов, которое сопровождает нейтрализацию кислоты или основания, лучше контролировать потенциометрически, чем при помощи индикаторов. [1]
Изменение концентрации водородных ионов, связанное с электролизом, определяется кислотно-основным титрованием; для получения точных результатов из раствора должна быть исключена двуокись углерода. [2]
Изменение концентрации водородных ионов резко сказывается на развитии всех физиологических функций микроорганизмов. С изменением рН меняется проницаемость клеточной оболочки, а следовательно, и условия питания. Ускоряется или тормозится деятельность микробных ферментов. [3]
Изменение концентрации водородных ионов в растворе оказывает противоположное влияние на величину энергии связей Pt - Н и Pt - С. В зависимости от соотношения, в котором изменяются энергии этих связей, рН по-разиому будет влиять на скорость как всего процесса, так и отдельных его стадий. Появляется возможность регулирования с помощью рН энергий связи реагирующих молекул с поверхностью катализатора, а в силу этого - возможность влиять не только на скорость процесса, но и на механизм, селиктивность и направление реакции гидрирования. Поэтому при подборе катализаторов гидрогенизации в жидкой фазе необходимо учитывать величину рН среды. [4]
Изменение концентрации водородных ионов, связанное с электролизом, определяется кислотно-основным титрованием; для получения точных результатов из раствора должна быть исключена двуокись углерода. [5]
Следовательно, при изменении концентрации водородных ионов в геометрической прогрессии величина рН изменяется в обратную сторону и притом в арифметической прогрессии. [6]
Следовательно, при изменении концентрации водородных ионов в геометрической прогрессии величина рН изменяется в обратную сторону и в арифметической прогрессии. [7]
Следовательно, при изменении концентрации водородных ионов в геометрической прогрессии величина рН изменяется в обратную сторону и притом в арифметической прогрессии. [8]
В подтверждение этого рассмотрим изменение концентрации водородных ионов во времени и рН в двойном слое и влияние этих факторов на изменение силы тока. Однако этот процесс происходит не мгновенно, некоторая часть ионов Н30 останется в переходной зоне, разряд ионов Н30 будет продолжаться. В связи с этим скорость электрохимической реакции сначала резко, а затем медленно будет уменьшаться до некоторой конечной величины. Наконец, скорость разряда Н30 и скорость - доставки их через переходную зону уравновесятся, наступит стационарное состояние. На кривых / - т это состояние выражается постоянным участком, не зависящим от времени. В первый момент после добавки ингибитора в кислоту рН приэлектродной зоны практически не будет отличаться от общего значения рН среды. Однако в результате продолжающегося разряда Н30 рН в переходной зоне будет постепенно увеличиваться, так как отвод образующегося эквивалентного количества ионов ОН - через переходную зону будет затруднен. [9]
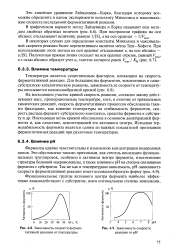 |
Зависимость скорости ферментативной реакции от температуры.| Зависимость скорости реакции от рН. [10] |
Ферменты крайне чувствительны к изменению концентрации водородных ионов. Это обусловлено такими причинами, как степень ионизации функциональных группировок, особенно в активном центре фермента, изменениями структуры белковой макромолекулы, а также влиянием рН на степень связывания фермента с субстратом. [11]
В некоторых случаях электролиты вызывают изменение концентрации водородных ионов раствора, как например хлористый аммоний. Собственно же влияние ионной силы не так велико. Экспериментально определенные значения для 1 - 1-и 2 - 1-зарядных электролитов ( хлориды натрия, кальция, магния и др.) равны 0 3 - 0 6; при увеличении концентрации выше 0 5 - 1 5 М коэффициент активности снова увгличивается, и, таким образом, значение активности приближается к значению концентрации. [12]
В некоторых случаях электролиты вызывают изменение концентрации водородных ионов раствора, как например хлористый аммоний. Собственно же влияние ионной силы не так велико. Экспериментально определенные значения для 1 - 1 и 2 - 1 зарядных электролитов ( хлориды натрия, кальция, магния и др.) равны 0 3 - 0 6; при увеличении концентрации выше 0 5 - 1 5 М коэффициент активности снова увеличивается, и, таким образом, значение активности приближается к значению концентрации. [13]
Такие растворы, которые сопротивляются изменению концентрации водородных ионов, называются буферными, растворами или буферными смесями. [14]
Изменение рН на единицу соответствует изменению концентрации водородных ионов в десять раз. [15]
Страницы: 1 2 3 4