Существование - гидрат
Cтраница 3
При температурах свыше соответствующего значения в точке С существование гидрата не возможно, как бы не велико было значение давления. В этой связи точка С рассматривается как критическая точка образования гидратов. В точке пересечения кривых 2 и 3 ( точка В) существует вторая инвариантная точка, в которой существуют газообразный гидратообразователь, жидкий раствор гидрато-образователя в воде, гидрат и лед. [32]
Как уже упоминалось выше, одним из основных условий существования гидрата является соотношение Ям ЯДИСс. [33]
 |
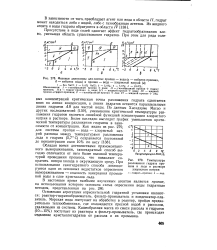
Влияние азота на гидратообразование сжиженных газов. [34] |
В присутствии вспомогательного газа ( азота) критическая температура существования гидрата сжиженного газа повышается. [35]
В связи с изложенным выше следует рассмотреть вопрос о существовании гидрата гидразина. Максимальные отклонения физических свойств ( за исключением поверхностного натяжения) для смесей гидразин - вода в жидком состоянии в пределах 10 % соответствуют эквимолекулярному соотношению компонентов. [36]
Наиболее обширное исследование системы H2S - Н2О ( в области существования гидратов) провели Селлек, Кар-майкл и Сейдж [100], которые получили равновесные значения Р - t для интервала температур от - 0 389 до 29 45 С и давлений от 0 917 до 22 10 атм. [37]
 |
Температура разложения гидрата пропана и льда в растворе хлористого натрия. / - гидрат - пропан. 2 - лед.| Потоковая схема установки для опреснения морской воды при помощи гидратов пропана. [38] |
Присутствие в воде солей сдвигает эффект гидратообразования влево, уменьшая область существования гидратов. Для некоторых солевых концентраций критическая точка разложения гидрата сдвигается вниз по линии конденсации, а линии гидратов остаются параллельными линии гидратов АВ для чистой воды. По данным [213], уменьшение критической температуры разложения гидратов является линейной функцией концентрации хлористого натрия в растворе. Более наглядно выглядит график уменьшения критической температуры разложения гидратов в зависимости от концентрации. Как видно из рис. 336, для системы пропан - вода - хлористый натрий разница между температурами разложения льда и гидрата ( 5 7 С) сохраняется постоянной до концентрации соли равной 10 мас. [39]
Для предупреждения гидратообразования необходимо устранить хотя бы одно из основных условий существования гидратов: высокое давление, низкую температуру или свободную влагу в г зе. [40]
Для предупреждения гидратообразования необходимо устранить хотя бы одно из основных условий существования гидратов: высокое давление, низкую температуру или свободную влагу в газе. [41]
 |
Фазовые диаграммы для систем. пропан - вода ( а - избыток пропана, б - избыток воды и пропан - вода - хлористый натрий ( а.| Температура разложения гидрата пропана и льда в растворе. [42] |
Присутствие в воде солей сдвигает эффект гидратообразования влево, уменьшая область существования гидратов. [43]
Так, у глиоксаля имеется, так сказать, только намок на существование постоянного гидрата; для бензоилмурапьиного альдегида, или, что то же, для фенилглиоксаля, имеется уже вполне определенный гидрат. Для дикетонов также известны постоянные гидраты, сюда относится целый ряд галоидозамещенных циклодикетонов, исследованных Цинке. Кроме того, допустить образование гидратов для дикетонов заставляет и то обстоятельство, что они вообще легко в присутствии щелочи фиксируют воду и распадаются. Допуская же, что во всех вышеприведенных реакциях исходными веществами являются гидраты, превращение их под влиянием щелочи можно представить следующим образом. На малоустойчивый карбонильный гидрат действует водный раствор щелочи, который представляет также химическое соединение нестойкое, находящееся в со-стоянии диссоциации. Происходит борьба между щелочью и карбонильной группой из-за воды, причем гидраты карбонильных соединений, теряя воду, могут обратно переходить в ангидридные формы. Превращение это может происходить двояким образом: или вода будет выделяться за счет двух водных остатков, стоящих при одном углеродном атоме, и в этом случае регенерируется первоначально введенное в реакцию вещество, или вода будет выделяться за счет двух водных остатков при двух соседних углеродных атомах, и в результате получится вещество окисного характера. Получающиеся окиси будут аналогичны тем, образование которых допущено при действии щелочи на охлоренные кетоны и альдегиды: они должны быть малостойкими и легко претерпевать изомерные превращения в соответственные оксикислоты. [44]
В 1890 г. русские ученые В. А. Кистяковский и И. А. Каблуков пришли к мысли о существовании гидратов ионов, а в-1914 г. Л. В. Писаржевский окончательно доказал правильность теории электролитической диссоциации, но при обязательном учете взаимодействия всех растворенных частиц с растворителем. Так, в результате объединения гидратной теории Менделеева и теории электролитической диссоциации, была создана современная теория растворов. [45]
Страницы: 1 2 3 4 5
