Анион - хлор
Cтраница 3
Наиболее известными стимуляторами локализованной коррозии являются анионы хлора, брома и йода. Однако в последнее время выявляется псе большее количество анионов, способных приводить к локализации коррозионного процеса. В частности, при определенных условиях нержавеющие стали подвержены питтин-говой коррозии в растворах уксусной кислоты. [31]
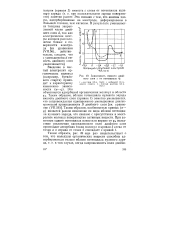 |
Зависимость емкости двойного слоя с от потенциала р. [32] |
Это связано с тем, что анионы хлора, адсорбированные на электроде, деформированы в большей степени, чем катионы. [33]
Интересно сопоставить влияние растворителя на адсорбцию анионов хлора на поверхности ртутного электрода. Расчет, проведенный Парсонсом и Деванатханом [72], показал, что анионы С1 - сильнее адсорбируются на ртути из растворов в метаноле, чем из водных растворов. Аналогичный результат был получен Корчинским [76], установившим, что адсорбция НС1 из этилового спирта больше, чем из воды. [34]
Нуклеофильное замещение, приводящее к вытеснению аниона хлора, становится затрудненным из-за наличия частичного положительного заряда на атоме хлора. На реакции электро-фильного присоединения к двойной связи указанный эффект не оказывает существенного влияния, поэтому Винилгалогениды проявляют обычные свойства алкенов. [35]
В некоторых случаях отщепление протона и аниона хлора происходит согласованно по донорно-акцепторному механизму. [36]
 |
Влияние возрастающих доз калия на поступление кальция в ячмень ( по Оверстриту и др. [37] |
Поскольку все катионы были связаны с анионами хлора, различие в их действии на пшеницу порознь и трех вместе обусловливалось только свойствами самих катионов. Каждый из них, особенно магний, задерживал рост корней, в то время как в некотором соотношении три катиона многократно усиливали их развитие. Односолевой раствор - типичный пример неуравновешенного питательного раствора, ибо составляющие его ионы не имеют конкурентов при поступлении в растение, насыщают обменную поглотительную способность корневой системы, что сказывается отрицательно на корнях, и создают неблагоприятные условия для питания всего растения. [38]
Таким образом, акцептором бензильного катиона является анион хлора. Как видно, эта реакция позволяет получать хлористый бензил из бензола. Рассмотренный ранее способ синтеза хлористого бензила хлорированием толуола ( см. 5.3) иногда менее удобен. [39]
Кристалл состоит из катионов натрия Na и анионов хлора СГ. Каждый из ионов сильно притягивается к шести ионам с зарядами противоположного знака, образующим октаэдр вокруг данного иона. Взаимодействия в этом кристалле можно описать, сказав, что каждый ион образует ионные связи с шестью своими соседями. [40]
Взаимодействие активных центров растущей полимерной молекулы с анионами хлора в окислительно-восстановительном реакционном комплексе приводит к обрыву цепи. Прекращение роста цепи может происходить также в результате превращения конца растущей макромолекулы в малоактивный стабильный радикал. Мягкие условия реакции и наличие активных центров на концах растущей молекулы сводят к минимуму вероятность разветвления цепи, имеющего место при реакции Ульмана и особенно Вюрца-Фиттига. При проведении процесса в мягких условиях сохраняются функциональные группы, содержащиеся в исходных продуктах, что обусловливает практически неограниченные возможности этого метода синтеза. [41]
В обмен на эти ионы в эритроцит поступают анионы хлора, для которых мембрана эритроцитов проницаема, в то время как натрий-другой составной элемент хлорида натрия, содержащегося в крови, остается в плазме. [42]
Стадия 3 - к хлорониевому иону быстро присоединяется анион хлора со стороны, противоположной хлору в хлорониевом ионе, что и определяет стереохимический результат реакции как анти-присоединение. [43]
Таким образом, потенциал каломельного электрода определяется активностью аниона хлора, не участвующего в электродной реакции. [44]
Таким образом, потенциал каломельного электрода определяется активностью аниона хлора, не окисляющегося на электроде. [45]
Страницы: 1 2 3 4