Комплексный анион
Cтраница 3
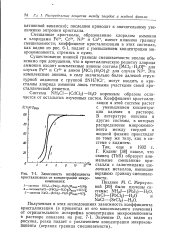 |
Зависимость коэффициента кристаллизации от концентрации микрокомпонента. [31] |
Эти комплексные анионы, в силу значительно более далекой структурной аналогии с группой 2NHJ4C1 -, могут входить в кристаллы хлорида аммония лишь готовыми участками своей кристаллической решетки. [32]
Многие комплексные анионы образуют с катионами тяжелых металлов малорастворимые и интенсивно окрашенные осадки. Образование желтого кристаллического осадка [ ( NH4) 3AsO4 - 12МоО3 ] - 6Н2О служит для открытия ионов мышьяка. [33]
Получающиеся комплексные анионы мало устойчивы и легко разрушаются при разбавлении водой - выпадает осадок AgCl. [34]
Эти комплексные анионы имеют максимально возможное для данного металла число координированных атомов галогенов, существование их в кристаллах хорошо известно, и, поскольку их спектры типичны для тетраэдрической структуры, можно почти точно предсказать их структуру в растворе. [35]
Некоторые комплексные анионы MoIV и WIV удается выделить в чистом виде. [36]
Разрушение комплексного аниона при попытках удаления сольватирующего катион адденда нельзя объяснять только следствием применения повышенной температуры или высокого вакуума; существенно важно понижение термодинамической устойчивости вещества при его десольватации; повидимому, многие из подобных веществ могут быть термодинамически устойчивыми только в виде кристаллосольватов. [37]
 |
Равновесие системы AICI3 - AIF3 - Н20 при 25. [38] |
Образование комплексных анионов подтверждается и заметным повышением растворимости A1F3 - 3H2O в присутствии плавиковой кислоты. Данные Николаева, Иванова и Колтыпина [33] мало точны и поэтому не приводятся подробно. [39]
Название комплексного аниона строится на тех же принципах, только между окончанием, показывающим валентность центрального атома, и названием внешнесферных групп ставится окончание ат. Например, соединение Кз [ Со ( МО2) б ] называется гексанитрокобальтиат калия, a K [ PtCl3NH3 ] - трихлороаминпла-тоат калия. [40]
Названия комплексных анионов строятся следующим образом. Перед корнем латинского названия элемента-комплексообразова-теля ставится префикс ( из греческих числительных), показывающий число лигандов, и название лиганда, а после - суффикс от. [41]
Образование комплексного аниона из соответствующих элементарных ионов обычно сопровождается некоторым уменьшением ядерного расстояния между центральным атомом и лигандами по сравнению с суммой их эффективных ионных радиусов. Вследствие допустимости такого сжатия, обусловленного наличием односторонней деформации лигандов комнлексообразователем, критические объемные соотношения для тех или иных структур становятся применительно к внутренней сфере комплексов иными, чем в обычных кристаллических решетках с их многосторонней деформацией ( XII § 2 доп. Поэтому проводимые на основе эффективных радиусов модельные расчеты максимально возможных для данных комплексообразова-телей и аддендов координационных чисел не всегда подтверждаются опытом. [42]
Для комплексных анионов [ 3 ( CN) e ] 3 дается следующий ряд относительной устойчивости: Со Fe Mn Cr V Ti. У элементов триад устойчивость однотипных цианидпых комплексов возрастает по направлению сверху вниз. [43]
Название комплексного аниона начинают с указания состава внутренней сферы. [44]
Для комплексных анионов все аналогично, только степени окисления центрального иона отмечаются суффиксами - ит или - ат. [45]
Страницы: 1 2 3 4