Изопропилциклопентан
Cтраница 1
Изопропилциклопентан получен гидрированием изопропенилцикло-пентана на платинированном угле при комнатной температуре и атмосферном давлении и очищен хроматографированием на силикагеле и перегонкой на колонке эффективностью 35 теоретических тарелок. [1]
Аналогично этому гидрогенолиз изопропилциклопентана по связи, прилежащей к заместителю ( направление а), также проходит с большей энергией активации по сравнению с гидрогенолизом по направлению б и в. Рассмотренные данные ясно показывают, что с увеличением экранирования С-С - связи кольца энергия активации ее гидрогенолиза возрастает. [2]
На примере гидрогенолиза 1 2-диметил - и изопропилциклопентанов показано, что экранирование связей пятичленного цикла боковыми цепями приводит к существенному увеличению энергий активации по сравнению с гидрогенолизом по неэкранированным связям кольца. [3]
Следует подчеркнуть, что суммарная энергия активации гидрогенолиза изопропилциклопентана ( 36 4 ккал / молъ) и взятого для сравнения этилциклопентана ( 35 5 ккал / молъ) оказалась практически такой же, как и у 1 2-диметилциклопентанов. Все они лежат в том же интервале 35 - 39 ккал / моль, в котором находятся и соответствующие величины, найденные для самого циклопентана и его двух ближайших гомологов. Таким образом, сделанный нами ранее вывод [4] о равенстве суммарных энергий активации гидрогенолиза самого циклопентана и его гомологов подтвержден теперь уже на примере пяти углеводородов, в том числе на примерах гомологов с разветвленной боковой цепью и с двумя боковыми цепями. Большее разнообразие строения изученных объектов делает обсуждаемый вывод более надежным. [4]
Наиболее простым углеводородом, имеющим такое строение, является изопропилциклопентан. [5]
Пятичленные цикланы общей формулы CsHis - я-пропилциклопен-тан [5], изопропилциклопентан [6] и 1-метил - 2-этилциклопентан [7] образуют смесь 1 3 - и 1 4-диметилциклогексанов. Следовательно, в этих-случаях равновесие сильно смещено в сторону шестичленных циклонов. [6]
Гомологи циклопентана общей формулы С8Н16 ( нормальный пропилцик-лопентан [10, 12], изопропилциклопентан [15] и 1-метил - 2-этилциклопен-тан [17]) в присутствии хлористого алюминия при 120 - 130 превращаются в основном в 1 3 - и 1 4-диметилциклогексаны. В связи с этим было изучено изомеризующее действие хлористого алюминия на гомологи циклогексана общей формулы С8Н16, в частности, на 1 1 - и 1 2-диметилциклогексан и этилциклогексан. [7]
Во франции С7 каталитического крекинга найдены диметил-циклопентаны и метилциклогексан, а в следующих фракциях - димет илциклогексаны, триметилциклопентаны, метилэтилцикло-нентаны и изопропилциклопентан. Обнаружены, но не идентифицированы нафтены С9 и высшие. [8]
Строение этого кетона было подтверждено отношением его к натрийамиду; в полном соответствии с отношением к этому реагенту камфенилона, а-метилкамфенилона ( фенхона) и ( 5-метилкамфенилона [6, 7] наш новый представитель этого ряда бициклических кетонов ( IX) превратился при нагревании с нат-рийамидом в амид соответствующей кислоты ( X), очевидно, а-пропилкамфенилоновой ( 1-пропил - З - изопропилциклопентан. [9]
В связи с этим была изучена [156] кинетика гидро-генолиза цис - и транс - 1 2-диметилциклопентанов, а также изопропилциклопентана. Оказалось, что энергии активации гидрогенолиза изопропилциклопентана и обоих 1 2-диметилциклопентанов достаточно близки ( соответственно, 152, 161 и 161 кДж / моль) и мало отличаются от энергии активации гидрогенолиза самого циклопента-на и его простейших гомологов. На примере гидрогенолиза названных углеводородов было показано, что экранирование связей пятичленного цикла объемистыми заместителями ( изопропильная группа) или алкильными группами в положениях 1 2 существенно увеличивает энергию активации по сравнению с гидрогенолизом неэкранированных связей кольца. Так, разница в значениях Е гидрогенолиза изопропилциклопентана по направлениям а и б ( или в) составляет 29 - 38 кДж / моль. [10]
Из приведенных реакций видно, что 1 1 2-триметшщиклопен-тан может быть получен изомеризацией как 1 1 -, так и 1 2-диметил-циклогексана. Для объяснения образования изопропилциклопен-тана необходимо сделать предположение, что 1 1-диметилцикло-гексан может в дальнейшем изомеризоваться с образованием соответствующего изомера с пятичленным кольцом в структуре, так как прямое образование изопропилциклопентана из любого другого изомера маловероятно. [11]
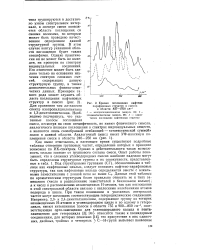 |
Кривая поглощения нафтено. [12] |
В этом случае контур указанной области поглощения будет также специфичен. Однако практически он не может быть ни выведен, ни проверен по спектрам индивудальных соединений. Для сравнения там же нанесен спектр изопропилциклопентана и 1 3-диметилпенталана. [13]
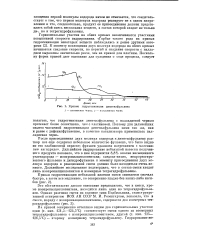 |
Кривые гидре гепизации диметилфульвеиа 1 - платиновая чернь. 2 - палладиевая чернь. [14] |
После присоединения двух молекул водорода к диметилфульвену раствор все еще содержал небольшое количество фульвена, что было видно по его слабожелтой окраске; фульвен удалялся нагреванием с малеино-вым ангидридом. Дальнейшее гидрирование небольшой навески полученного продукта показало, что в нем содержится 8 8 % вполне насыщенного углеводорода - изопропилциклопентана; следовательно, непрореагировавшего фульвена и дигидрофульвена к моменту присоединения двух молекул водорода в реакционной смеси должно было находиться очень немного. Дальнейшее исследование подтвердило, что в состав смеси входят лишь изопропилциклопентан и изомерные тетрагидрофульвены. [15]
Страницы: 1 2