А-заместитель
Cтраница 3
Интересно, что увеличение объема алкилирующего агента в большей степени снижает скорость реакции, чем такое же увеличение размера а-заместителя. Например, 2-метилпиридин реагирует с этилиодидом при 25 С в 18 раз медленнее, чем 2-этилпиридин с метилиодидом. [31]
Позднее более детальное изучение этого вопроса показало, что дегидратация вызывается различными реагентами и зависит от типа аминоза-щитных групп, а-заместителя и условий реакции. Ангидросоеди-нения выделены из продуктов пептидного синтеза, осуществлявшегося карбодиимидным [273, 1191, 1809], фосфороксихлорид-ным [1419] и тетраэтилпирофосфитным [1191] методами. Даже в сравнительно мягких условиях, например при активировании карбоксильной группы образованием смешанного ангидрида с алкилхлорформиатами, - толуолсульфохлоридом или бензол-сульфохлоридом [1420] в водной среде, дегидратация все же имеет место. Если же одним из компонентов смешанного ангидрида является изовалериановая кислота, то дегидратации не происходит. Бензилоксикарбониль - ный остаток у карбобензокси-р-циан-ь - аланина можно отщепить обработкой натрием в безводном жидком аммиаке, не затрагивая нитрильную группу. [32]
Изучение кинетики УУ-аминирования пиридинов показало, что реакция имеет первый порядок по каждому реагенту и относительно мало чувствительна к стерическим помехам со стороны а-заместителей. [33]
Естественно, что протоноакцепторные свойства карбонильной группы, определяющие реакционную способность метиленхинонов в реакциях данного типа, изменяются в зависимости от характера сопряжения системы метиленхинона с а-заместителем. Под влиянием аминогруппы не только увеличивается реакционная способность карбонильной группы, но и дополнительно облегчается хинон-фенольная перегруппировка связей, так как аминогруппа способствует стабилизации первоначально возникающего иона карбония за счет образования азометиновой связи с ярко выраженным электрофильным характером. Образовавшийся в этом случае катион может реагировать с любой нуклеофильной частицей, в том числе и с водой, с дальнейшим отщеплением аминогруппы. [34]
Полное преобладание формы ( А) обязано одновременной стабилизации дииминной формы ( А) благодаря р-тс-сопряжению в альдогидразонной части и дестабилизации сопряженной формы ( Б) вследствие введения а-заместителя. [35]
Восстановление ло методу Кижиера - Вольфа протекает легче всего с производными кетоисв, замещенными в а положении электроотрицательными группами, а также с арилкарбонильными соединениями [3,31,54,55] Однако наличие а-заместителей может усложнить ход реакции. В 1913 г. Кижиер заметил, что гидроксиль-ная группа в а-положеини может подвергаться элиминированию е образованием ненасыщенного углеводорода [56] Позднее элиминирование наблюдалось также у циклических а-аминокетоиов, что было использовано для синтеза ачацнклаиов с 9 - и 10-членными кольцами [57] Карбонильные ненасыщенные соединения обычно превращаются в непредельные углеводороды [17, 58], ио в случае а, [ 3-неиасыщенных соединений могут иметь место побочные реакции. [36]
При изучении химии тиофена становится совершенно очевидным, что у вступающих атомов или групп существует заметная тенденция замещать в молекуле тиофена чаще а-водородный атом, чем р-водородный; при реакциях а-заместители элиминируются легче, нежели - заместители. [37]
Так, две алко-ксикарбонильные группы понижают рКа приблизительно до 13; рКа а-нитропиррола составляет 10 6; 2 4-динитропиррола 6 15; 2 5-динитропиррола 3 6, что указывает на более эффективное сопряжение электроноакцепторных а-заместителей с неподеленной электронной парой атома азота. Галогенные заместители также заметно повышают кислотность пирролов. [38]
В а р-ненасыщенных карбонильных и карбоксильных соединениях каждый алкильный заместитель, введенный в а - и р-положе-ние вызывает сдвиг 10 - 12 нм, в а р у б-ненасыщенных карбонильных и карбоксильных соединениях вклад а-заместителя составляет 10 нм, р-заместителя 12 нм и у - и 6-заместителей IS нм. Вклад незамещенного а р-ненасыщенного альдегида составляет 209 нм, ке-тона 215 нм и кислоты или эфира 197 нм. Добавление сопряжений двойной связи к а р-ненасыщенному кетону вызывает длинноволновый сдвиг 30 нм. При расчете полос карбонил - и карбоксилсодер-жащих соединений необходимо учитывать поправку на влияние растворителя. [39]
Если учесть, что для всех собственно алкилгид-роперекисей величины энергии активации Е2 очень близки ( в реакции с ацетальдегидом 3 - 4 ккал / моль, в реакции с циклогексано-ном 7 - 7 5 ккал / моль), то следует отнести наблюдаемые различия в реакционной способности, в первую очередь, на счет стерических затруднений, оказываемых а-заместителями реакции присоединения. Наличие слабых внутримолекулярных водородных связей в кумил-и тетралилгидроперекисях не оказывает заметного влияния на способность этих гидроперекисей присоединяться к альдегидам и кетонам. [40]
Если учесть, что для всех собственно алкилгид-роперекисей величины энергии активации Е2 очень близки ( в реакции с ацетальдегидом 3 - 4 ккал / моль, в реакции с циклогексано-ном 7 - 7 5 ккал / моль), то следует отнести наблюдаемые различия в реакционной способности, в первую очередь, на счет стерических затруднений, оказываемых а-заместителями реакции присоединения. Наличие слабых внутримолекулярных водородных связей в кумшь и тетралилгидроперекисях не оказывает заметного влияния на способность этих гидроперекисей присоединяться к альдегидам и кетонам. [41]
В таком фурановом соединении, имеющем электроположительный а-заме-ститель, как 2-бромфуран, введение второго заместителя обусловливается несколькими факторами. Электронодонорный а-заместитель имеет тенденцию направлять входящую группу в а - положение. Примеры, в которых фуран, уже имеющий в а-положении электроположительный заместитель, давал значительный выход дизамещенного фурана, где новая группа занимала бы - положение, неизвестны. [42]
В спектрах протонного магнитного резонанса ( Н - ЯМР) сама карбонильная группа, естественно, неактивна, но протоны при соседних атомах углерода проявляются в характеристической области ( 8 2 1), которая изменяется предсказуемым образом при присоединении других заместителей. Конфигурацию а-заместителей часто можно установить по химическому сдвигу оставшегося а-про-тона и констант его взаимодействия с Р - или иногда с - протонами. Это особенно полезно в а-галогенциклогексанонах. В а р-непредельных кетонах в результате типичного смещения электронов р-углеродный атом испытывает некоторый дефицит электронов, так что присоединенные к нему протоны сильнее дезэкрани-рованы ( их сигналы сдвинуты в сторону больших значений 8), чем протоны при а-углеродном атоме. Аналогично, хотя и менее сильно, дезэкранированы метильные группы, находящиеся у р-уг-леродного атома. Цис - или транс-расположение протонов, а иногда и алкильных групп, влияет на константу взаимодействия между ними. [43]
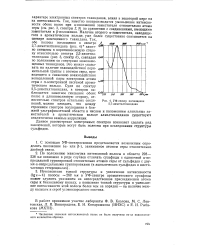 |
УФ-спектр поглощения 2 7-диметилтиаиндана. [44] |
Так, заметно воспроизводится уменьшение интенсивности обеих полос при - положении заместителя относительно атома серы ( см. рис. 3, спектры 2, 3) по сравнению с соединениями, имеющими заместители в р-положении. Наличие второго а-заместителя, находящегося в ароматическом кольце, уже более существенно сказывается на спектре замещенного тиаиндана. [45]
Страницы: 1 2 3 4