Электрохимическое восстановление - соединение
Cтраница 1
Электрохимическое восстановление соединения 15 в ДМФ приводит к фрагментации по реакциям ( 61) и ( 62) со скоростью 9 5 с - при 19 5 С и с энергией активации 21 ккал / моль. [1]
Электрохимическое восстановление соединений I и II как в нейтраль - Ной [ на фоне ( C4H9) 4NBr ], так и в щелочной ( буфер) средах дает двухступенчатую полярограмму. [2]
Токи электрохимического восстановления соединения кобаль-та ( Ш) с 2-нитрозо - 1-нафтолом при одной и той же концентрации ионов Со2 в растворе приблизительно в 2 раза выше максимальных токов электрохимического восстановления соединения кобальта с 1-нитрозо - 2-нафтолом. При малых концентрациях реагента это явление не наблюдается. [3]
Из выдержанного раствора, зависимость максимального тока электрохимического восстановления соединения от продолжительности его образования имеет обычный вид. Это явление следует учитывать, пользуясь методом добавок. Вводимые в анализируемый раствор стандартные растворы должны содержать комплексы никеля ( II) с диметилглиоксимом. Соотношение никеля и диметилглиоксима выбирают в соответствии с данными, приведенными выше. [5]
Другой особенностью системы никель - диметилглиоксим является зависимость максимального тока электрохимического восстановления соединения от продолжительности его образования из свежеприготовленных растворов - максимальный катодный ток линейно увеличивается при увеличении продолжительности осаждения. Пассивация электрода в широком концентрационном и временном интервале не наблюдается. Прямые, описывающие зависимость максимального тока восстановления от продолжительности пред-электролиза, отсекают на оси абсцисс отрезки, которые увеличиваются при уменьшении концентрации реагента-осадителя в растворе. При достаточно большой концентрации диметилглиоксима прямая выходит из начала координат. [6]
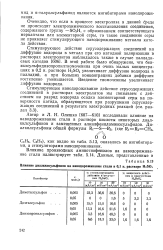 |
Влияние диалкилсульфонов на наводороживание стали в 0 1 н. растворе H2SO. [7] |
Очевидно, что если в процессе электролиза в данной с реде не происходит электрохимического восстановления соединения, содержащего группу - SO3H, с образованием соответствующего меркаптана или элементарной серы, то такое соединение серы не проявляет стимулирующего наводороживание металла катода действия. [8]
Токи электрохимического восстановления соединения кобаль-та ( Ш) с 2-нитрозо - 1-нафтолом при одной и той же концентрации ионов Со2 в растворе приблизительно в 2 раза выше максимальных токов электрохимического восстановления соединения кобальта с 1-нитрозо - 2-нафтолом. При малых концентрациях реагента это явление не наблюдается. [9]
Оптимальный потенциал концентрирования составляет - 0 5 в. Электрохимическое восстановление соединения происходит в интервале потенциалов от - 1 0 до - 1 2 в и на интегральной кривой маскируется током восстановления фона. Дифференциальные кривые выражены значительно лучше, поэтому их регистрировать целесообразнее. [11]
Это дает возможность использовать образование малорастворимых соединений на поверхности электроактивного электрода с последующей регистрацией тока их электрохимического растворения как метод определения микроколичеств анионов. Зависимость формы и положения поляризационной кривой относительно оси потенциалов позволяет изучать кинетику процессов электрохимического восстановления соединений. [12]
Переносят раствор в электролизер, пропускают азот 10 мин и затем вводят 0 2 мл 2 - 10 - 4 М щелочного раствора 2-нитрозо - 1-нафтола. Проводят электролиз перемешиваемого раствора в течение 5 мин при потенциале 0 в. При этом кобальт концентрируется на электроде в виде соединения с нитрозонафтолом. Останавливают мешалку и регистрируют катодную поляризационную кривую электрохимического восстановления соединения кобальта с нитрозонафтолом в интервале потенциалов от - 0 5 до - 0 8 в. Измеряют максимальный катодный ток. Концентрацию ионов Со2 находят по калибровочному графику или методом добавок. [13]
Страницы: 1